10.3:
분자의 기하학적 구조 예측
A subscription to JoVE is required to view this content. Sign in or start your free trial.
JoVE Core
Chemistry
Predicting Molecular Geometry
VSEPR 이론은 전자-쌍 기하학 구조와 분자 기하학 구조를 결정하는 데 도움이 됩니다. 일련의 단계들은 삼염화인과 같은 분자의 기하학적 구조와 결합 각도를 예측하는 데 사용됩니다. 첫 번째 단계는 분자의 루이스 구조를 그리는 것입니다.다음으로, 중심 원자의 총 전자 그룹의 수를 셉니다. 인 주위에는 네 개의 전자 그룹이 있고, 세 개의 결합 쌍과 한 개의 고립 전자쌍이 있습니다. 이제 전자-쌍 기하학 구조를 결정합니다.전자쌍 기하학 구조는 사면체입니다. 그러나 고립 전자쌍으로 하여 분자 기하학 구조는 삼각 피라미드입니다. 고립 전자쌍은 결합 각도를 109.5도 이하로 감소시킵니다.이산화탄소의 전자-쌍 기하학 및 분자 구조를 예측하기 위해 동일한 프로토콜을 사용합니다. 이산화탄소의 루이스 구조는 탄소 원자 주위의 두 개의 전자 그룹을 보여주는데 이것은 각 이중 결합이 하나의 전자 그룹으로 간주되기 때문입니다. 2-전자 그룹은 중심 탄소 원자의 반대쪽에서 결합 각도가 180도 되게 방향을 잡습니다.중심 원자에 고립 전자쌍이 없기 때문에 전자-쌍과 분자 기하학은 동일하며, 이산화탄소 분자는 선형입니다. 사염화텔루르의 루이스 구조는 텔루르 원자 주위에 네 개의 결합 쌍과 한 개의 고립된 쌍의 다섯 개의 전자 그룹을 가지고 있습니다. 전자 그룹은 삼각 쌍뿔 기하학 구조를 가지고 있습니다.고립 전자쌍은 수평 위치 중 하나를 차지하고 분자는 시소 모양입니다. 이 단계들은 다시 사염화 요오드 음이온의 전자-쌍 기하학과 분자 구조를 결정하는 데 사용될 수 있습니다. 루이스 구조는 요오드 원자 주위에 여섯 개의 전자 그룹 즉 네 개의 결합 쌍과 두 개의 고립된 쌍을 가지고 있습니다.전자 그룹은 팔면 배열을 가지고 있습니다. 결합 쌍은 한 평면에 놓이고 고립된 쌍은 이 평면의 양쪽에 배치되어 반발력을 최소화합니다. 분자 기하학 구조는 정사각형 평면입니다.
10.3:
분자의 기하학적 구조 예측
전자 쌍 기하학의 결정에 대한 VSEPR 이론
다음 절차는 VSEPR 이론을 사용하여 전자 쌍 형상 및 분자 구조를 결정합니다.
- 분자 또는 다원자 이온의 루이스 구조를 작성합니다.
- 중앙 원자 주위의 전자 그룹(외로운 쌍 및 채권)의 수를 계산합니다. 단일, 이중 또는 삼중 결합은 전자 밀도의 한 영역으로 계산됩니다.
- 전자 그룹의 수에 따라 전자 쌍 형상을 식별합니다: 선형, 삼각 평면, 테트라헤드랄, 삼각 성 바이피라미드, 또는 옥타히드랄(그림 1, 첫 번째 열에 묘사된 대로).
- 분자 구조를 결정하기 위해 외로운 쌍의 수를 사용합니다. 외로운 쌍과 화학 결합의 두 개 이상의 배열이 가능하다면, 외로운 쌍이 단일 채권보다 더 많은 공간을 차지하는 여러 채권보다 더 많은 공간을 차지한다는 것을 기억하면서 반발을 최소화 할 하나를 선택하십시오. 삼각 이중 피라미드 배열에서, 모든 외로운 쌍이 적도 위치에있을 때 반발이 최소화됩니다. 두 개의 외로운 쌍과 옥타 헤드랄 배열에서, 외로운 쌍중앙 원자의 반대편에있을 때 반발을 최소화한다.
분자 구조는 고독한 쌍이 없을 때 전자 쌍 형상과 동일합니다. 특정 수의 전자 쌍의 경우, 하나 이상의 외로운 쌍을 위한 분자 구조는 해당 전자 쌍 형상의 수정에 따라 결정됩니다.
VSEPR 이론을 사용하여 분자 구조 예측
다음 예는 분자 구조를 예측하기 위해 VSEPR 이론의 사용을 보여줍니다.
CO2 및 BCl3의전자 쌍 형상 및 분자 구조를 결정하는 방법을 살펴보겠습니다.
우리는 CO2의 루이스 구조를 다음과 같이 작성합니다.
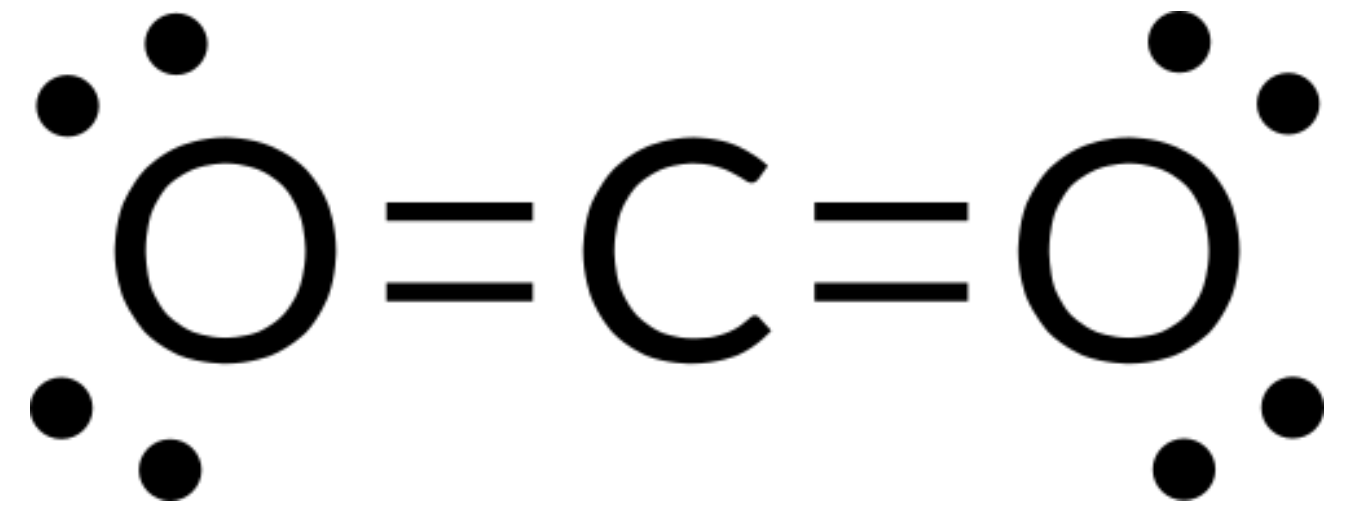
이것은 우리에게 탄소 원자 주위에 두 개의 이중 결합을 보여줍니다 – 각 이중 결합은 하나의 전자 그룹으로 계산하고, 탄소 원자에 외로운 쌍이 없습니다. VSEPR 이론을 사용하여, 우리는 두 전자 그룹이 180 °의 결합 각도로 중앙 원자의 반대편에 자신을 배치 할 것으로 예측합니다. 전자 쌍 형상 및 분자 구조는 동일하며 CO2 분자는 선형입니다.
TeCl4 분자의 전자 쌍 형상 및 분자 구조를 예측하기 위해, 첫 번째 단계는 TeCl4의루이스 구조를 작성하는 것입니다. 그것은 Te 원자 의 주위에 5개의 전자 단을 나타냅니다: 1개의 외로운 쌍 및 4개의 결합 쌍:
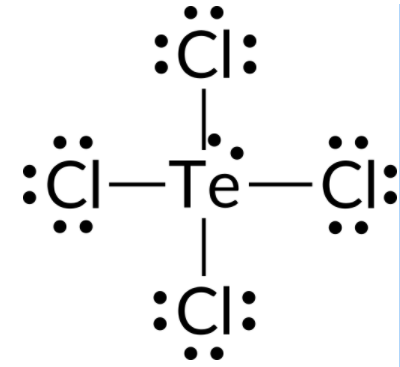
우리는 이 5개의 전자 단이 삼각성 바이피라미드 전자 쌍 기하학을 채택할 것으로 예상합니다. 외로운 쌍의 반발을 최소화하기 위해, 외로운 쌍은 적도 위치 중 하나를 차지한다. 분자 구조는 시소의 것입니다.
