10.3:
Previsão da Geometria Molecular
10.3:
Previsão da Geometria Molecular
Teoria da VSEPR para Determinação de Geometrias de Pares de Eletrões
O procedimento que se segue usa a teoria VSEPR para determinar as geometrias de pares de eletrões e as estruturas moleculares:
- Escreva a estrutura de Lewis da molécula ou do ião poliatómico.
- Conte o número de grupos de eletrões (pares solitários e ligações) em torno do átomo central. Uma ligação simples, dupla, ou tripla conta como uma região de densidade de eletrões.
- Identifique a geometria do par de eletrões com base no número de grupos de eletrões: linear, trigonal plana, tetraédrica, trigonal bipiramidal ou octaédrica (como representado na Figura 1, primeira coluna).
- Utilize o número de pares solitários para determinar a estrutura molecular. Se for possível mais do que um arranjo de pares solitários e ligações químicas, escolha o que minimizará as repulsões, lembrando que pares solitários ocupam mais espaço do que ligações múltiplas, que ocupam mais espaço do que ligações simples. Em arranjos trigonais bipiramidais, a repulsão é minimizada quando cada par solitário está em uma posição equatorial. Em um arranjo octaédrico com dois pares solitários, a repulsão é minimizada quando os pares solitários estão em lados opostos do átomo central.
As estruturas moleculares são idênticas às geometrias de pares de eletrões quando não há pares solitários presentes. Para um número específico de pares de eletrões, as estruturas moleculares para um ou mais pares solitários são determinadas com base nas modificações da geometria correspondente do par de eletrões.
Previsão de Estruturas Moleculares Utilizando a Teoria da VSEPR
Os exemplos que se seguem ilustram o uso da teoria da VSEPR para prever as estruturas moleculares.
Vamos ver como determinar a geometria de pares de eletrões e a estrutura molecular de CO2 e BCl3.
Escrevemos a estrutura de Lewis de CO2 como:
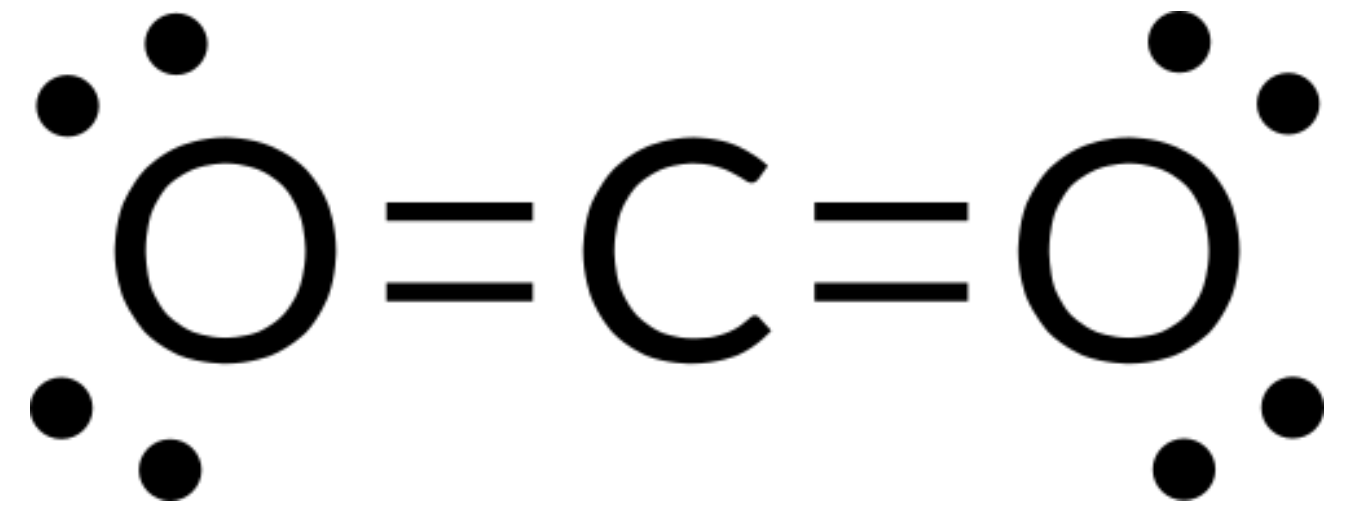
Isto mostra-nos duas ligações duplas em torno do átomo de carbono—cada ligação dupla conta como um grupo de eletrões, e não existem pares solitários no átomo de carbono. Utilizando a teoria da VSEPR, prevemos que os dois grupos de eletrões se arranjam em lados opostos do átomo central com um ângulo de ligação de 180°. A geometria do par de eletrões e a estrutura molecular são idênticas, e as moléculas de CO2 são lineares.
Para prever a geometria de pares de eletrões e a estrutura molecular de uma molécula de TeCl4, o primeiro passo é escrever a estrutura de Lewis de TeCl4. Ele indica cinco grupos de eletrões em torno do átomo de Te: um par solitário e quatro pares de ligação:
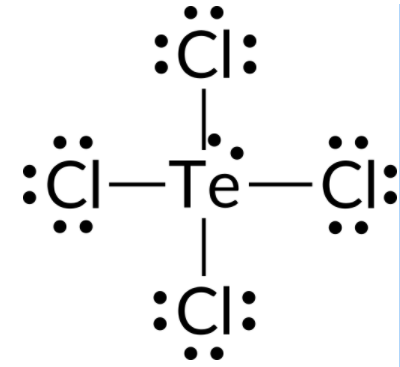
Esperamos que estes cinco grupos de eletrões adoptem uma geometria de pares de eletrões trigonal bipiramidal. Para minimizar repulsões de pares solitários, o par solitário ocupa uma das posições equatoriais. A estrutura molecular é a de um balancé.
Este texto foi adaptado de Openstax, Chemistry 2e, Section 7.6: Molecular Structure and Polarity.
