11.17:
Solides métalliques
11.17:
Solides métalliques
Les solides métalliques tels que les cristaux de cuivre, d’aluminium et de fer sont formés par des atomes de métaux. La structure des cristaux métalliques est souvent décrite comme une répartition uniforme des noyaux atomiques dans une “ mer ” d’électrons délocalisés. Les atomes à l’intérieur d’un solide métallique sont maintenus ensemble par une force unique appelée liaison métallique qui donne lieu à de nombreuses propriétés majeures utiles et variées.
Tous les solides métalliques présentent une conductivité thermique et électrique élevée, un éclat métallique et une malléabilité. Beaucoup sont très durs et assez résistants. En raison de leur malléabilité (la capacité de se déformer sous la pression ou le martelage), ils ne se brisent pas et, par conséquent, font des matériaux de construction utiles. Les points de fusion des métaux varient considérablement. Le mercure est un liquide à température ambiante et les métaux alcalins fondent en dessous de 200 °C. Plusieurs métaux de post-transition ont également des points de fusion bas, alors que les métaux de transition fondent à des températures supérieures à 1000 °C. Ces différences reflètent les différences entre les forces des liaisons métalliques parmi les métaux.
Propriétés des solides métalliques
En raison de leur structure cristalline, les solides métalliques présentent peu de propriétés uniques associées à la structure et ont été organisés dans le tableau suivant.
| Type de solide | Type de particules | Type d’attractions | Propriétés | Exemples |
| Métallique | Atomes d’éléments électropositifs | Liaisons métalliques | Brillant, malléable, ductile, conduit bien la chaleur et l’électricité, dureté et température de fusion variables | Cu, Fe, Ti, Pb, U |
Structure cristalline des solides métalliques : assemblage compact
Les solides qui sont faits d’atomes identiques peuvent avoir deux types d’arrangements : carrés ou compacts (figure 1). Comme l’assemblage compact maximise les attractions globales entre les atomes et minimise l’énergie intermoléculaire totale, les atomes de la plupart des métaux s’assemblent de cette manière.

Figure 1. Arrangement carré ou compact.
Nous trouvons deux types d’assemblage le plus compact dans des structures cristallines métalliques simples : l’assemblage hexagonal le plus compact (HCP), et l’assemblage cubique le plus compact (CCP). Les deux consistent en des couches répétitives d’atomes disposés de façon hexagonale. Dans les deux types, une deuxième couche (B) est placée sur la première couche (A) de sorte que chaque atome de la deuxième couche soit en contact avec trois atomes de la première couche. La troisième couche est positionnée de deux façons.
Dans l’HCP, les atomes de la troisième couche sont directement au-dessus des atomes de la première couche (c.-à-d. que la troisième couche est également de type A), et l’empilement consiste en une alternance de couches compactes de type A et de type B (c.-à-d. ABABAB⋯) (figure 2a).
Dans le CCP, les atomes de la troisième couche ne sont pas au-dessus des atomes de l’une ou l’autre des deux premières couches (c’est-à-dire que la troisième couche est de type C), et l’empilement consiste en une alternance de couches compactes de type A, B et C (c’est-à-dire ABCABCABC⋯) (figure 2b). Les arrangements cubiques à faces centrées (FCC) et CCP sont en fait les mêmes structures avec un assemblage compact des atomes, occupant 74 % du volume.
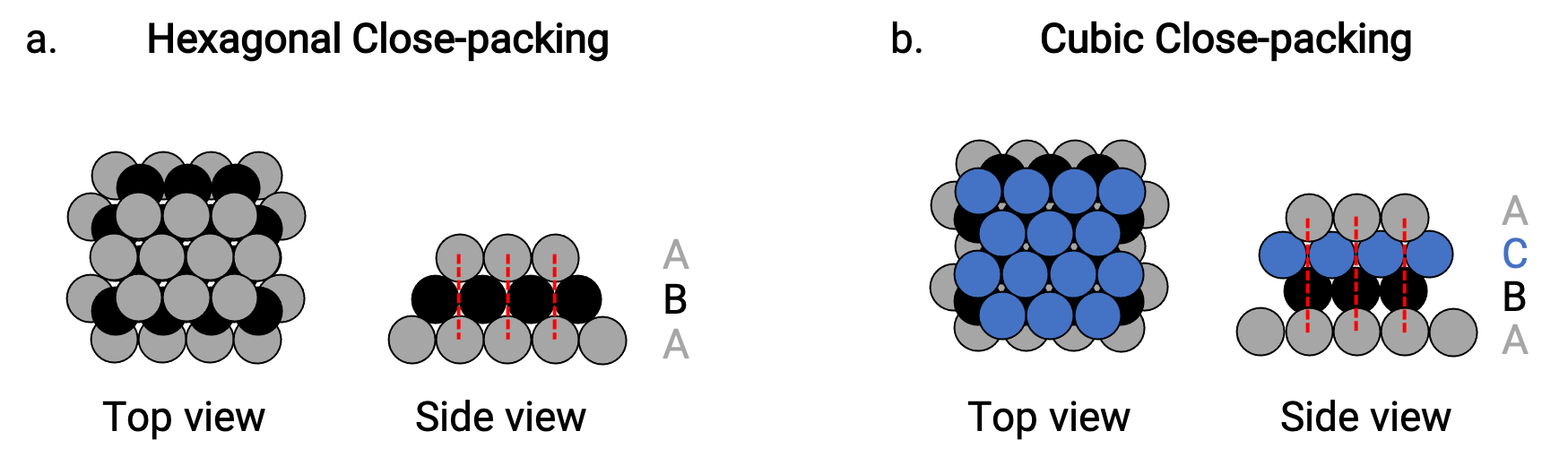
Figure 2. (a) L’assemblage hexagonal compact se compose de deux couches alternées (ABABAB…). (b) L’assemblage cubique compact se compose de trois couches alternées (ABCABCABC…).
Dans les deux types d’assemblage, chaque atome entre en contact avec six atomes dans sa propre couche, trois dans la couche au-dessus et trois dans la couche au-dessous. Ainsi, chaque atome touche 12 voisins proches et a donc un nombre de coordination de 12.
Environ les deux tiers de tous les métaux cristallisent dans des empilements compacts avec des nombres de coordination de 12. Les métaux qui cristallisent avec une structure HCP incluent le Cd, Co, Li, Mg, Na, et le Zn, et les métaux qui cristallisent dans une structure CCP comprennent l’Ag, Al, Ca, Cu, Ni, Pb et le Pt.
Ce texte a été adapté d’Openstax, Chimie 2e, sections 10.5 l’état solide de la matière, et 10.6 structures du réseau dans les solides cristallins.
