11.17:
金属固体
11.17:
金属固体
銅やアルミニウム、鉄の結晶などの金属固体は、金属原子によって形成されています。金属結晶の構造は、原子核が一様に分布し、電子の海の中に電子が非集中的に集まっていると表現されることが多いです。このような金属固体内の原子は、金属結合と呼ばれる力で結合しており、それが多くの有用で多様なバルク特性を生み出しています。
すべての金属固体は、高い熱伝導性、電気伝導性、金属光沢、展延性を示し、多くは非常に硬く、かなり強いです。槌で叩いたり、圧力をかけたりして変形させることができるため、粉々になることがなく、建築材料としても有用です。金属の融点は様々です。水銀は常温では液体であり、アルカリ金属は200°C以下で融解します。遷移金属は1000°C以上で融解しますが、ポスト遷移金属は融点が低いものもあります。これらの違いは、金属同士の結合の強さの違いを反映しています。
金属固体の性質
金属固体はその結晶構造に起因するいくつかのユニークな性質を示します。
| 固体の種類 | 構成する原子 | 特徴の種類 | 物理的特性 | 代表例 |
| 金属 | 電気的陽性な原子 | 金属結合 | 光沢がある、可鍛性がある、延性がある、熱や電気をよく通す、硬度や融点が変化する | 。 <td style="color: black; border:Cu, Fe, Ti, Pb, U |
金属固体の結晶構造:近接配列
同一の原子でできた固体には、正方形と密着型の2種類の配列がある(Figure 1)。近接配列は、原子間の総合的な引力を最大にし、分子間の総エネルギーを最小にするので、ほとんどの金属の原子はこのような配列になっています。

Figure 1. 正方形と最密充填の配置
Figure 1. 正方形と最密充填の配置
単純な金属の結晶構造には、六方最密充填(HCP)と立方最密充填(CCP)という2種類の最密充填があります。どちらも六角形に配列された原子の層が繰り返されています。どちらも、第1層(A)の上に第2層(B)を重ね、第2層の各原子が第1層の3つの原子と接しています。
HCPでは、第1層の原子の真上に第3層の原子があり(すなわち第3層もタイプA)、タイプAとタイプBの層が交互に積層されています。(すなわちABAB⋯)(Figure 2a)
CCPは、3層目の原子が1~2層目の原子よりも上にない状態(3層目がC型)で、A型、B型、C型が交互に積み重なった構造(ABCABC⋯)になっている(Figure 2b)。立方晶面心(FCC)配列とCCP配列は、実は同じ構造であり、体積の74%を占める原子がコンパクトに充填されています。
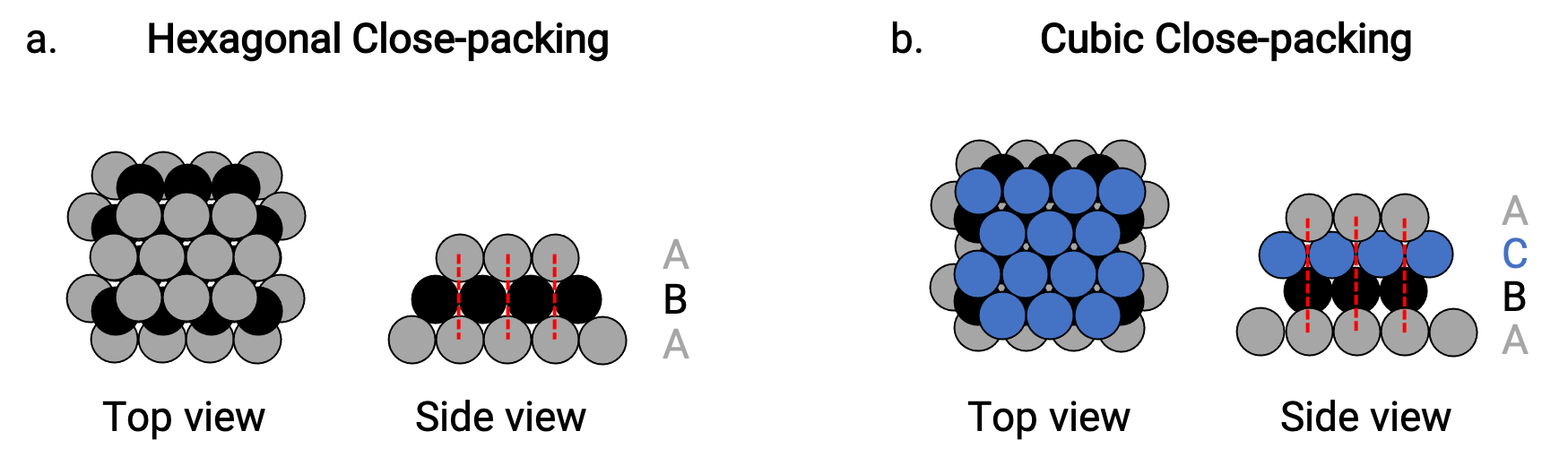
Figure 2( a )六角形の最密充填は、2つの交互の層(ABABAB…)で構成されます。 ( b )立方最密充填は3つの交互の層で構成される(ABCABCABC…)。
どちらのタイプの充填でも、各原子はそれ自体の層で6つの原子、上の層で3つ、下の層で3つの原子と接触しています。したがって、各原子は隣接する12個の原子に接触するため、配位数は12になります。
すべての金属の約3分の2は、配位数12の最密配列で結晶化します。HCP構造で結晶化する金属には、Cd、Co、Li、Mg、Na、およびZn、および結晶化する金属が含まれます。 CCP構造には、Ag、Al、Ca、Cu、Ni、Pb、およびPtが含まれます。
上記の文章は以下から引用しました。 Openstax、Chemistry 2e、Sections 10.5 The Solid State of Matter 、および 10.6結晶性固体の格子構造
