11.17:
Sólidos Metálicos
11.17:
Sólidos Metálicos
Sólidos metálicos como cristais de cobre, alumínio, e ferro são formados por átomos de metal. A estrutura dos cristais metálicos é frequentemente descrita como uma distribuição uniforme dos núcleos atómicos dentro de um “mar” de eletrões desocalizados. Os átomos dentro de um sólido metálico são mantidos juntos por uma força única conhecida como ligação metálica que dá origem a muitas importantes propriedades úteis e variadas.
Todos os sólidos metálicos apresentam alta condutividade térmica e elétrica, lustro metálico, e maleabilidade. Muitos são muito duros e bastante fortes. Devido à sua maleabilidade (capacidade de deformação sob pressão ou marteladas), não se estilhaçam e, por conseguinte, constituem materiais de construção úteis. Os pontos de fusão dos metais variam muito. O mercúrio é um líquido à temperatura ambiente e os metais alcalinos derretem abaixo de 200 °C. Vários metais de pós-transição também têm pontos de fusão baixos, enquanto que os metais de transição derretem a temperaturas acima de 1000 °C. Essas diferenças refletem diferenças nas forças da ligação metálica entre metais.
Propriedades dos Sólidos Metálicos
Devido à sua estrutura cristalina, os sólidos metálicos apresentam poucas propriedades exclusivas associadas à estrutura e foram tabuladas na tabela seguinte.
| Tipo de Sólido | Tipo de Partículas | Tipo de Atrações | Propriedades | Exemplos |
| Metálico | Átomos de elementos eletropositivos | Ligações Metálicas | brilhante, maleável, dúctil, conduz bem calor e eletricidade, dureza e temperatura de fusão variáveis | Cu, Fe, Ti, Pb, U |
Estrutura Cristalina de Sólidos Metálicos: Empacotamento Compacto
Sólidos que são feitos de átomos idênticos podem ter dois tipos de arranjos: quadrado ou de empacotamento compacto (Figura 1). Uma vez que o empacotamento compacto maximiza as atrações gerais entre átomos e minimiza a energia intermolecular total, os átomos na maioria dos metais compacta-se desta forma.

Figura 1. Arranjo quadrado vs de empacotamento compacto.
Encontramos dois tipos de empacotamento compacto em estruturas cristalinas metálicas simples: empacotamento compacto hexagonal (HCP) e empacotamento compacto cúbico (CCP). Ambos consistem em camadas repetidas de átomos arranjados hexagonalmente. Em ambos os tipos, uma segunda camada (B) é colocada na primeira camada (A) de modo que cada átomo da segunda camada esteja em contacto com três átomos da primeira camada. A terceira camada é posicionada de duas maneiras.
No HCP, os átomos da terceira camada estão diretamente acima dos átomos da primeira camada (ou seja, a terceira camada também é do tipo A), e o empilhamento consiste em camadas de empacotamento compacto do tipo A e do tipo B alternadas (ou seja, ABABAB⋯) (Figura 2a).
No CCP, os átomos da terceira camada não estão acima dos átomos de nenhuma das duas primeiras camadas (ou seja, a terceira camada é do tipo C), e o empilhamento consiste em camadas de empacotamento compacto do tipo A, tipo B, e tipo C alternadas (ou seja, ABCABCABC⋯) (Figura 2b). Os arranjos cúbicos centrados na face (FCC) e CCP são na verdade as mesmas estruturas com empacotamento compacto de átomos, ocupando 74% do volume.
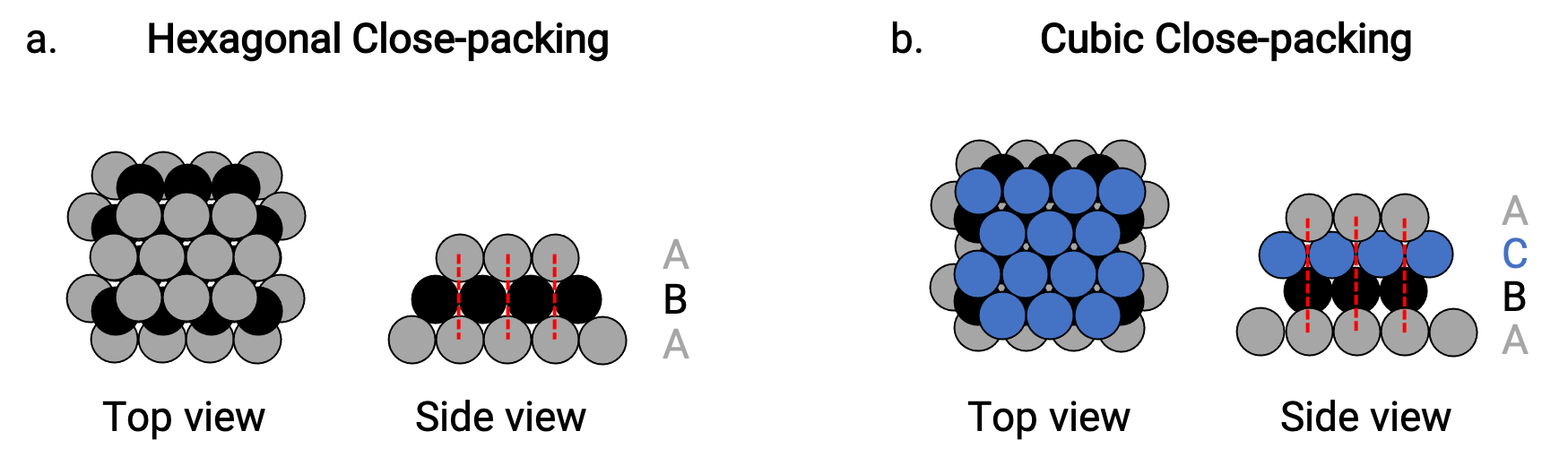
Figura 2. (a) O empacotamento compacto hexagonal consiste em duas camadas alternadas (ABABAB…). (b) O empacotamento compacto cúbico é constituído por três camadas alternadas (ABCABCABC…).
Em ambos os tipos de empacotamento, cada átomo entra em contacto com seis átomos da sua própria camada, três da camada acima, e três da camada abaixo. Assim, cada átomo toca 12 vizinhos próximos e, portanto, tem um número de coordenação de 12.
Cerca de dois–terços de todos os metais cristalizam em arranjos de empacotamento compacto com números de coordenação de 12. Metais que cristalizam em uma estrutura HCP incluem Cd, Co, Li, Mg, Na, e Zn, e metais que cristalizam em uma estrutura CCP incluem Ag, Al, Ca, Cu, Ni, Pb, e Pt.
Este texto foi adaptado de Openstax, Chemistry 2e, Sections 10.5 The Solid State of Matter, e 10.6 Lattice Structures in Crystalline Solids.
