11.17:
Sólidos Metálicos
11.17:
Sólidos Metálicos
Los sólidos metálicos, como los cristales de cobre, aluminio y hierro, están formados por átomos de metal. La estructura de los cristales metálicos se describe a menudo como una distribución uniforme de los núcleos atómicos dentro de un “mar” de electrones deslocalizados. Los átomos dentro de tal sólido metálico están unidos por una fuerza única conocida como enlace metálico que da lugar a muchas propiedades a granel útiles y variadas.
Todos los sólidos metálicos presentan alta conductividad térmica y eléctrica, brillo metálico y maleabilidad. Muchos son muy duros y bastante fuertes. Debido a su maleabilidad (la capacidad de deformarse bajo presión o martilleo), no se rompen y, por lo tanto, hacen materiales de construcción útiles. Los puntos de fusión de los metales varían ampliamente. El mercurio es un líquido a temperatura ambiente y los metales alcalinos se funden por debajo de 200 °C. Varios metales post transicionales también tienen puntos de fusión bajos, mientras que los metales de transición se funden a temperaturas superiores a 1000 °C. Estas diferencias reflejan diferencias en las fuerzas de enlaces metálicos entre metales.
Propiedades de los sólidos metálicos
Debido a su estructura cristalina, los sólidos metálicos presentan pocas propiedades únicas asociadas con la estructura y se han tabulado en la siguiente tabla.
| Tipo de sólido | Tipo de partículas | Tipo de atracciones | Propiedades | Ejemplos |
| Metálico | Átomos de elementos electropositivos | Enlaces metálicos | brillante, maleable, dúctil, conduce bien el calor y la electricidad, dureza y temperatura de fusión variable | Cu, Fe, Ti, Pb, U |
Estructura cristalina de los sólidos metálicos: empaquetamiento compacto
Los sólidos que están hechos de átomos idénticos pueden tener dos tipos de arreglos: Cúbico o empaquetamiento compacto (Figura 1). Dado que el empaquetado compacto maximiza las atracciones generales entre los átomos y minimiza la energía intermolecular total, los átomos de la mayoría de los metales se empaquetan de esta manera.

Figura 1.Arreglo cúbico vs compacto.
Encontramos dos tipos de empaquetamiento compacto en estructuras cristalinas metálicas simples: Empaquetamiento hexagonal compacto (HCP por sus siglas en inglés) y empaquetamiento cúbico compacto (CCP por sus siglas en inglés). Ambos consisten en capas repetitivas de átomos dispuestos hexagonalmente. En ambos tipos, se coloca una segunda capa (B) en la primera capa (A) de modo que cada átomo de la segunda capa esté en contacto con tres átomos de la primera capa. La tercera capa se coloca de dos maneras.
En el HCP, los átomos de la tercera capa están directamente por encima de los átomos de la primera capa (es decir, la tercera capa también es de tipo A), y el apilamiento consiste en alternas capas compactas de tipo A y tipo B (es decir, ABABAB⋯) (Figura 2a).
En el CCP, los átomos de la tercera capa no están por encima de los átomos en ninguna de las dos primeras capas (es decir, la tercera capa es de tipo C), y el apilamiento consiste en capas alternadas de tipo A, tipo B y tipo C (es decir, ABCABCABC⋯) (Figura 2b). Los arreglos cúbicos centrados en las caras (FCC) y CCP son en realidad las mismas estructuras con un embalaje compacto de átomos, ocupando el 74% del volumen.
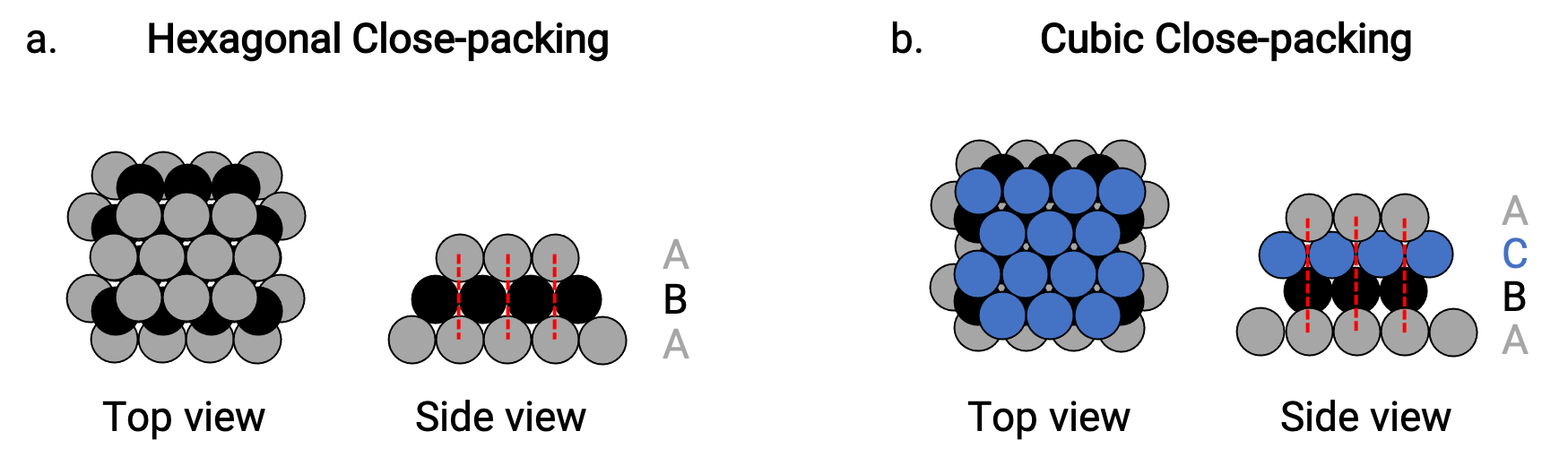
Figura 2.(a) El empaquetamiento hexagonal compacto consiste en dos capas alternas (ABABAB…). (b) El empaquetamiento cúbico compacto consiste en tres capas alternas (ABCABCABC…).
En ambos tipos de empaquetamiento, cada átomo entra en contacto con seis átomos en su propia capa, tres en la capa superior y tres en la capa inferior. Así cada átomo toca 12 vecinos cercanos y por lo tanto tiene un número de coordinación de 12.
Alrededor de dos tercios de todos los metales cristalizan en arreglos compactos con números de coordinación de 12. Los metales que cristalizan en una estructura de HCP incluyen Cd, Co, Li, Mg, Na, y Zn, y metales que cristalizan en una estructura CCP incluyen Ag, Al, Ca, Cu, Ni, Pb y Pt.
Este texto ha sido adaptado de Openstax, Química 2e, Secciones 10,.5 El Estado Sólido de la Materia, y 10.6 Estructuras de Celosía en Sólidos Cristalinos.
