12.11:
الأسموزية والضغط الأسموزي للمحاليل
12.11:
الأسموزية والضغط الأسموزي للمحاليل
يُظهر عدد من المواد الطبيعية والاصطناعية نفاذية انتقائية، مما يعني أن الجزيئات أو الأيونات ذات الحجم والشكل والقطبية والشحنة المعينة وما إلى ذلك هي فقط القادرة على المرور عبر (اختراق) المادة. أغشية الخلايا البيولوجية تقديم أمثلة أنيقة للنفاذ الانتقائي في الطبيعة، في حين أن أنابيب غسيل الكلى المستخدمة لإزالة النفايات الاستقلابية من الدم هي مثال تكنولوجي أكثر بساطة. وبغض النظر عن كيفية تصنيعها، يُشار إلى هذه المواد عمومًا باسم أغشية شبه منفذة.
ضع في اعتبارك جهازاً على شكل حرف U، حيث يتم فصل عينات من المذيب النقي عن المحلول بغشاء يمكن أن تتخلل جزيئات المذيب فقط. سوف تنتشر جزيئات المذيب عبر الغشاء في كلا الاتجاهين. نظرًا لأن تركيز المذيب أكبر في المذيب النقي من المحلول، فإن هذه الجزيئات ستنتشر من جانب المذيب من الغشاء إلى جانب المحلول بمعدل أسرع مما هو عليه في الاتجاه العكسي. والنتيجة هي النقل الصافي لجزيئات المذيب من المذيب النقي إلى المحلول. يُعرف النقل المدفوع بالانتشار لجزيئات المذيبات عبر غشاء شبه نافذ باسم التناضح.
عندما يتم إجراء الأسموزية في جهاز موصوف أعلاه، يزداد حجم المحلول حيث يصبح مخففاً بتراكم المذيب. يؤدي هذا إلى ارتفاع مستوى المحلول ، مما يزيد من ضغطه الهيدروستاتيكي (بسبب وزن عمود المحلول في الأنبوب) وينتج عنه نقل أسرع لجزيئات المذيب إلى جانب المذيب النقي. عندما يصل الضغط إلى قيمة ينتج عنها معدل نقل مذيب عكسي يساوي معدل التناضح ، يتوقف النقل السائب للمذيب. يسمى هذا الضغط الضغط الأسموزي (Π) من المحلول. يرتبط الضغط الأسموزي لمحلول مخفف بمولارية المذاب، M، ودرجة الحرارة المطلقة، T، وفقاً للمعادلة
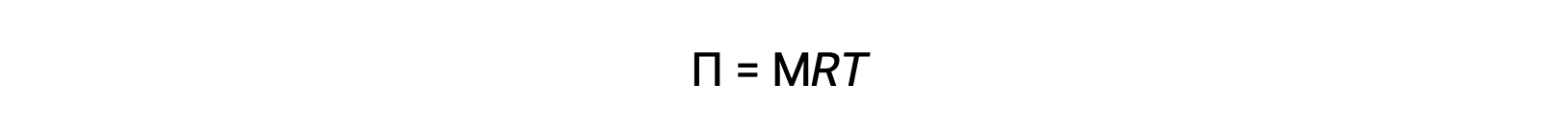
حيث R هو ثابت الغاز العام.
إذا تم وضع محلول في مثل هذا الجهاز، فإن الضغط الذي يزيد عن الضغط الأسموزي للمحلول يعكس عملية التناضح ويدفع جزيئات المذيب من المحلول إلى المذيب النقي. تُستخدم تقنية التناضح العكسي هذه في تحلية مياه البحر على نطاق واسع وعلى نطاقات أصغر لإنتاج مياه الصنبور عالية النقاء للشرب.
هذا النص مقتبس من Openstax, Chemistry 2e, Section 11.4: Colligative Properties.
Suggested Reading
- Goodhead, Lauren K., and Frances M. MacMillan. "Measuring osmosis and hemolysis of red blood cells." Advances in physiology education 41, no. 2 (2017): 298-305.
- Garbarini, G. R., R. F. Eaton, T. K. Kwei, and A. V. Tobolsb. "Diffusion and reverse osmosis through polymer membranes." Journal of Chemical Education 48, no. 4 (1971): 226.
- Hitchcock, David I. "Osmotic pressure and molecular weight." Journal of Chemical Education 28, no. 9 (1951): 478.
