12.11:
Ozmos ve Solüsyonların Ozmatik Basıncı
12.11:
Ozmos ve Solüsyonların Ozmatik Basıncı
Bir dizi doğal ve sentetik malzeme, seçici nüfuz etme sergiler, yani yalnızca belirli bir boyut, şekil, polarite, yük ve benzeri moleküllerin veya iyonların malzemeden geçme (nüfuz etme) yeteneğine sahip olduğu anlamına gelir. Biyolojik hücre zarları, doğada seçici nüfuz etmenin zarif örneklerini sağlarken, metabolik atıkları kandan uzaklaştırmak için kullanılan diyaliz tüpü daha basit bir teknolojik örnektir. Nasıl imal edildiklerine bakılmaksızın, bu malzemeler genellikle yarı geçirgen membranlar olarak anılır.
Saf çözücü ve çözelti örneklerinin yalnızca çözücü moleküllerinin nüfuz edebileceği bir zarla ayrıldığı U-şekilli bir aparat düşünün. Çözücü moleküller, zar boyunca her iki yönde de yayılacaktır. Çözücü konsantrasyonu saf çözücüde çözeltiden daha fazla olduğu için, bu moleküller, zarın çözücü tarafından çözelti tarafına ters yönde olduklarından daha hızlı bir oranda yayılacaktır. Sonuç, çözücü moleküllerinin saf çözücüden çözeltiye net bir transferidir. Solvent moleküllerinin yarı geçirgen bir membrandan difüzyona dayalı transferi, ozmoz olarak bilinen bir süreçtir.
Yukarıda açıklanan bir aparatta ozmoz gerçekleştirildiğinde, çözücü birikmesiyle seyreltikçe çözeltinin hacmi artar. Bu, çözelti seviyesinin yükselmesine, hidrostatik basıncının artmasına (tüpteki çözelti kolonunun ağırlığına bağlı olarak) ve çözücü moleküllerinin saf çözücü tarafına daha hızlı aktarılmasına neden olur. Basınç, ozmoz hızına eşit bir ters çözücü transfer hızı veren bir değere ulaştığında, çözücünün toplu transferi durur. Bu basınca, çözeltinin ozmotik basıncı (Π) denir. Denkleme göre seyreltik bir çözeltinin ozmotik basıncı çözünen molaritesi, M ve mutlak sıcaklığı T ile ilişkilidir.
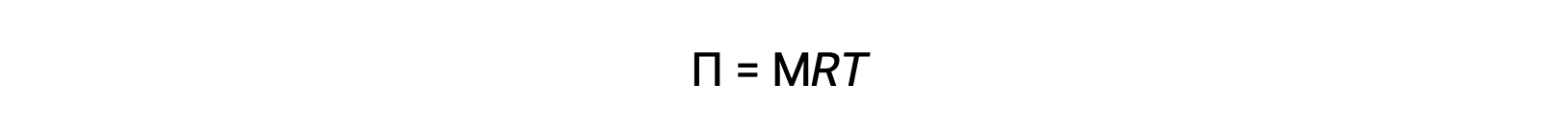
R evrensel gaz sabitidir.
Böyle bir aparata bir çözelti yerleştirilirse, çözeltinin ozmotik basıncından daha yüksek basınç uygulamak ozmozu tersine çevirir ve çözücü moleküllerini çözeltiden saf çözücüye iter. Bu ters ozmoz tekniği, deniz suyunun büyük ölçekli tuzdan arındırılması için ve içme için yüksek saflıkta musluk suyu üretmek için daha küçük ölçeklerde kullanılır.
Bu metin bu kaynaktan uyarlanmıştır Openstax, Chemistry 2e, Section 11.4: Colligative Properties.
Suggested Reading
- Goodhead, Lauren K., and Frances M. MacMillan. "Measuring osmosis and hemolysis of red blood cells." Advances in physiology education 41, no. 2 (2017): 298-305.
- Garbarini, G. R., R. F. Eaton, T. K. Kwei, and A. V. Tobolsb. "Diffusion and reverse osmosis through polymer membranes." Journal of Chemical Education 48, no. 4 (1971): 226.
- Hitchcock, David I. "Osmotic pressure and molecular weight." Journal of Chemical Education 28, no. 9 (1951): 478.
