12.11:
Osmosi e pressione osmotica delle soluzioni
12.11:
Osmosi e pressione osmotica delle soluzioni
Un certo numero di materiali naturali e sintetici mostrano una permeazione selettiva, il che significa che solo molecole o ioni di una certa dimensione, forma, polarità, carica e così via, sono in grado di passare attraverso (permeare) il materiale. Le membrane cellulari biologiche forniscono eleganti esempi di permeazione selettiva in natura, mentre i tubi di dialisi utilizzati per rimuovere i rifiuti metabolici dal sangue sono un esempio tecnologico più semplicistico. Indipendentemente da come possono essere fabbricati, questi materiali sono generalmente indicati come membrane semipermeabili.
Si consideri un apparato a forma di U, in cui campioni di solvente puro e una soluzione sono separati da una membrana che solo le molecole di solvente possono permeare. Le molecole di solvente si diffonderanno attraverso la membrana in entrambe le direzioni. Poiché la concentrazione di solvente è maggiore nel solvente puro rispetto alla soluzione, queste molecole si diffonderanno dal lato solvente della membrana al lato della soluzione ad una velocità più veloce di quella che faranno nella direzione inversa. Il risultato è un trasferimento netto di molecole di solvente dal solvente puro alla soluzione. Il trasferimento guidato dalla diffusione di molecole di solvente attraverso una membrana semipermeabile è un processo noto come osmosi.
Quando l’osmosi viene eseguita in un apparato sopra descritto, il volume della soluzione aumenta man mano che viene diluita dall’accumulo di solvente. Ciò fa aumentare il livello della soluzione, aumentando la sua pressione idrostatica (a causa del peso della colonna della soluzione nel tubo) e risultando in un più rapido trasferimento di molecole di solvente al lato solvente puro. Quando la pressione raggiunge un valore che produce una velocità di trasferimento inversa del solvente pari al tasso di osmosi, il trasferimento sfuso di solvente cessa. Questa pressione è chiamata pressione osmotica (Π) della soluzione. La pressione osmotica di una soluzione diluita è correlata alla sua molarità soluta, M, e alla temperatura assoluta, T, secondo l’equazione
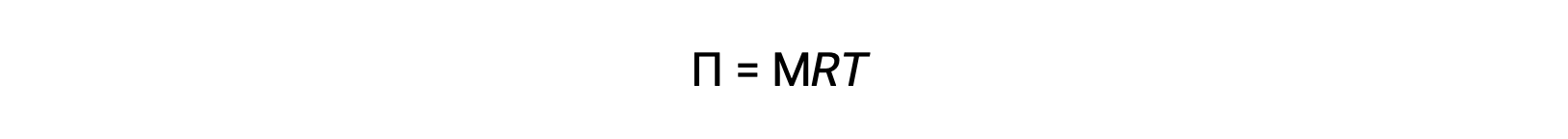
dove R è la costante universale del gas.
Se una soluzione viene posta in un tale apparato, l’applicazione di una pressione maggiore della pressione osmotica della soluzione inverte l’osmosi e spinge le molecole di solvente dalla soluzione nel solvente puro. Questa tecnica di osmosi inversa viene utilizzata per la desalinizzazione su larga scala dell’acqua di mare e su scale più piccole per produrre acqua di rubinetto ad alta purezza per bere.
Questo testo è adattato da Openstax, Chimica 2e, Sezione 11.4: Proprietà Colligative.
Suggested Reading
- Goodhead, Lauren K., and Frances M. MacMillan. "Measuring osmosis and hemolysis of red blood cells." Advances in physiology education 41, no. 2 (2017): 298-305.
- Garbarini, G. R., R. F. Eaton, T. K. Kwei, and A. V. Tobolsb. "Diffusion and reverse osmosis through polymer membranes." Journal of Chemical Education 48, no. 4 (1971): 226.
- Hitchcock, David I. "Osmotic pressure and molecular weight." Journal of Chemical Education 28, no. 9 (1951): 478.
