12.11:
Osmose e Pressão Osmótica de Soluções
12.11:
Osmose e Pressão Osmótica de Soluções
Vários materiais naturais e sintéticos exibem permeação selectiva, o que significa que apenas moléculas ou iões de um determinado tamanho, forma, polaridade, carga, etc., são capazes de passar através (permear) do material. As membranas celulares biológicas fornecem exemplos elegantes da permeação selectiva na natureza, enquanto que os tubos da diálise usados para remover lixo metabólico do sangue é um exemplo tecnológico mais simplista. Independentemente de como possam ser fabricados, esses materiais são geralmente chamados de membranas semipermeáveis.
Considere um aparelho em forma de U, no qual as amostras de solvente puro e de uma solução são separadas por uma membrana que apenas as moléculas de solvente podem permear. As moléculas de solvente difundem-se através da membrana em ambas as direções. Uma vez que a concentração de solvente é maior no solvente puro do que na solução, estas moléculas difundem-se do lado do solvente da membrana para o lado da solução a uma velocidade mais rápida do que na direção inversa. O resultado é uma transferência líquida de moléculas de solvente do solvente puro para a solução. A transferência por difusão de moléculas de solvente através de uma membrana semipermeável é um processo conhecido como osmose.
Quando a osmose é efectuada em um aparelho acima descrito, o volume da solução aumenta à medida que é diluída devido à acumulação de solvente. Isso faz com que o nível da solução suba, aumentando a sua pressão hidrostática (devido ao peso da coluna da solução no tubo) e resultando em uma transferência mais rápida de moléculas de solvente de volta para o lado do solvente puro. Quando a pressão atinge um valor que produz uma taxa de transferência inversa de solvente igual à taxa de osmose, a maioria da transferência do solvente cessa. Esta pressão é chamada de pressão osmótica (Π) da solução. A pressão osmótica de uma solução diluída está relacionada com a molaridade do seu soluto, M, e a temperatura absoluta, T, de acordo com a equação
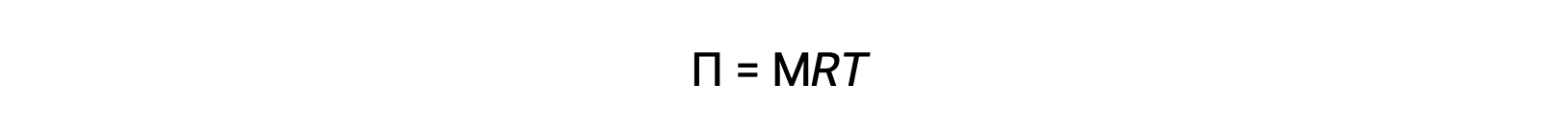
onde R é a constante de gás universal.
Se uma solução for colocada em tal aparelho, aplicar uma pressão superior à pressão osmótica da solução inverte a osmose e empurra as moléculas de solvente da solução para o solvente puro. Esta técnica de osmose inversa é utilizada para a dessalinização em grande escala da água do mar e em escalas mais pequenas para produzir água canalizada de elevada pureza para beber.
Este texto é adaptado de Openstax, Chemistry 2e, Section 11.4: Colligative Properties.
Suggested Reading
- Goodhead, Lauren K., and Frances M. MacMillan. "Measuring osmosis and hemolysis of red blood cells." Advances in physiology education 41, no. 2 (2017): 298-305.
- Garbarini, G. R., R. F. Eaton, T. K. Kwei, and A. V. Tobolsb. "Diffusion and reverse osmosis through polymer membranes." Journal of Chemical Education 48, no. 4 (1971): 226.
- Hitchcock, David I. "Osmotic pressure and molecular weight." Journal of Chemical Education 28, no. 9 (1951): 478.
