13.3:
Concentração e Lei da Velocidade
13.3:
Concentração e Lei da Velocidade
A velocidade de uma reação é afetada pelas concentrações de reagentes. As leis de velocidade (leis de velocidade diferencial) ou equações de velocidade são expressões matemáticas que descrevem a relação entre a velocidade de uma reação química e a concentração dos seus reagentes.
Por exemplo, em produtos de uma reação genérica aA + bB ⟶, onde a e b são coeficientes estequiométricos, a lei da velocidade pode ser escrita como:
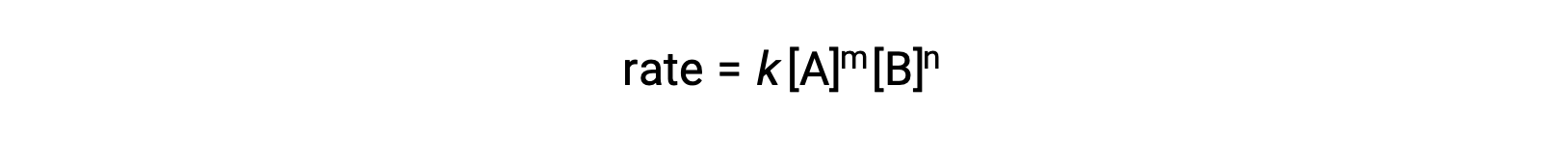
[A] e [B] representam as concentrações molares dos reagentes, e k é a constante de velocidade, que é específica para uma reação particular a uma temperatura específica.
Os expoentes m e n são as ordens de reação e são tipicamente inteiros positivos, embora possam ser frações, negativos, ou zero.
A constante de velocidade k e as ordens de reação m e n são determinadas experimentalmente observando como a velocidade de uma reação muda à medida que as concentrações dos reagentes são alteradas. A constante de velocidade k é independente das concentrações dos reagentes, mas varia com a temperatura.
As ordens de reação em uma lei de velocidade descrevem a dependência matemática da velocidade em concentrações de reagentes. No que se refere à lei de velocidade genérica (velocidade = k[A]m[B]n), a reacção é de ordem m no que se refere A e de ordem n no que se refere a B. Por exemplo, se m = 1 e n = 2, a reação é de primeira ordem em A e de segunda ordem em B. A ordem de reação geral é simplesmente a soma das ordens para cada reagente. Para este exemplo de lei de velocidade, a reação é de terceira ordem no geral (1 + 2 = 3).
Uma abordagem experimental comum para a determinação das leis de velocidade é o método das velocidades iniciais. Este método envolve a medição das velocidades de reação para ensaios experimentais múltiplos efetuados com diferentes concentrações iniciais de reagentes. A comparação das velocidades medidas para estes ensaios permite determinar as ordens de reação e, posteriormente, a constante da velocidade, que em conjunto são utilizadas para formular uma lei de velocidade.
As leis de velocidade podem exibir ordens fracionárias para alguns reagentes, e ordens de reação negativas são às vezes observadas quando um aumento na concentração de um reagente causa uma diminuição na velocidade de reação. É importante notar que as leis de velocidade são determinadas apenas por experiência e não são previstas de forma confiável pela estequiometria da reação.
A ordem da reação determina a relação entre a velocidade de reação e a concentração de reagentes ou produtos.
• Em uma reação de ordem zero, a concentração dos reagentes não tem nenhum efeito sobre a velocidade da reação, que permanece constante durante todo o tempo.
• Em uma reação de primeira ordem, a velocidade de reação é diretamente e linearmente proporcional à mudança na concentração de reagentes. À medida que a concentração de reagentes diminui, a velocidade de reação também diminui proporcionalmente.
• Em reações de segunda ordem ou superiores, a velocidade de reação é proporcional ao valor exponencial dos reagentes. Portanto, à medida que a reação progride e a concentração dos reagentes diminui, a velocidade de reação diminui exponencialmente.
Este texto é adaptado de Openstax, Chemistry 2e, Section 12.3: Rate Laws.
