13.3:
Concentración y Ley de Velocidad
13.3:
Concentración y Ley de Velocidad
La velocidad de una reacción se ve afectada por las concentraciones de los reactivos. Las leyes de velocidad (leyes de velocidad diferencial) o ecuaciones de velocidad son expresiones matemáticas que describen la relación entre la velocidad de una reacción química y la concentración de sus reactivos.
Por ejemplo, en una reacción genérica aA + bB ⟛ productos, donde a y b son coeficientes estequiométricos, la ley de velocidad puede escribirse como:
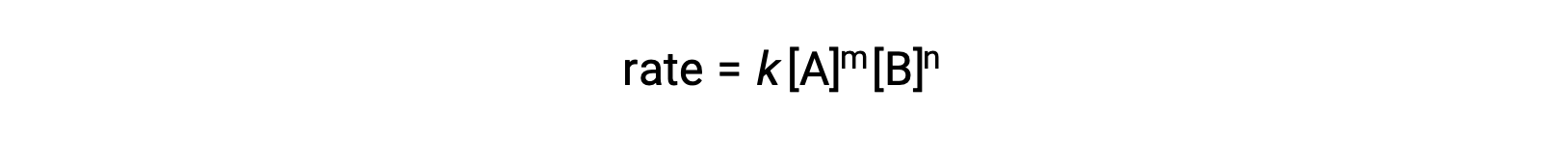
[A] y [B] representan las concentraciones molares de los reactantes, y k es la constante de velocidad, que es específica para una reacción particular a una temperatura específica.
Los exponentes m y n son los órdenes de la reacción y suelen ser enteros positivos, aunque pueden ser fracciones, negativos o cero.
La constante de velocidad k y los órdenes de la reacción m y n se determinan experimentalmente observando cómo cambia la velocidad de una reacción a medida que cambian las concentraciones de los reactivos. La constante de velocidad k es independiente de las concentraciones de los reactivos, pero varía con la temperatura.
Los órdenes de la reacción en una ley de velocidad describen la dependencia matemática entre la velocidad y las concentraciones de los reactantes. Refiriéndose a la formula general de la ley de velocidad (velocidad = k[A]m[B]n), la reacción es de orden m con respecto a A y de orden n con respecto a B. Por ejemplo, si m = 1 y n = 2, La reacción es de primer orden en A y de segundo orden en B. El orden de reacción global es simplemente la suma de los órdenes para cada reactivo. Para el ejemplo de la ley de velocidad aquí, la reacción es de tercer orden en general (1 + 2 = 3).
Un enfoque experimental común para la determinación de las leyes de velocidad es el método de las velocidades iniciales. Este método consiste en medir las velocidades de reacción en múltiples ensayos experimentales realizados utilizando diferentes concentraciones iniciales de reactivos. La comparación de las velocidades medidas para estos ensayos permite determinar los órdenes de reacción y, posteriormente, la constante de velocidad, que juntos se utilizan para formular una ley de velocidad.
Las leyes de velocidad pueden mostrar órdenes fraccionarios para algunos reactivos, y en ocasiones se observan órdenes de reacción negativos cuando un aumento en la concentración de un reactivo provoca una disminución en la velocidad de la reacción. Es importante notar que las leyes de velocidad son determinadas solamente experimentalmente y no son predecibles de manera confiable mediante la estequiometría de reacción.
El orden de reacción determina la relación entre la velocidad de reacción y la concentración de reactivos o productos.
• En una reacción de orden cero, la concentración de los reactivos no tiene ningún efecto sobre la velocidad de la reacción, que permanece constante durante todo el proceso.
• En una reacción de primer orden, la velocidad de reacción es directa y linealmente proporcional al cambio en la concentración de los reactivos. A medida que disminuye la concentración de los reactivos, la tasa de reacción también disminuye proporcionalmente.
• En las reacciones de segundo orden o de mayor orden, la velocidad de reacción es proporcional al valor exponencial de los reactivos. Por lo tanto, a medida que la reacción progresa y la concentración de los reactivos disminuye, la velocidad de reacción disminuye exponencialmente.
Este texto es adaptado de Openstax, Química 2e, Sección 12.3: Leyes de velocidad.
