13.3:
Закон о концентрации и скорости
13.3:
Закон о концентрации и скорости
На скорость реакции влияют концентрации реагентов. Законы нормы (законы о дифференциальной скорости) или уравнения ставок — это математические выражения, описывающие соотношение между скоростью химической реакции и концентрацией ее реагенты.
Например, в общей реакции AA + BB ⟶ продукты, где a и b являются стехиометрическими коэффициентами, закон о ставке можно записать как:
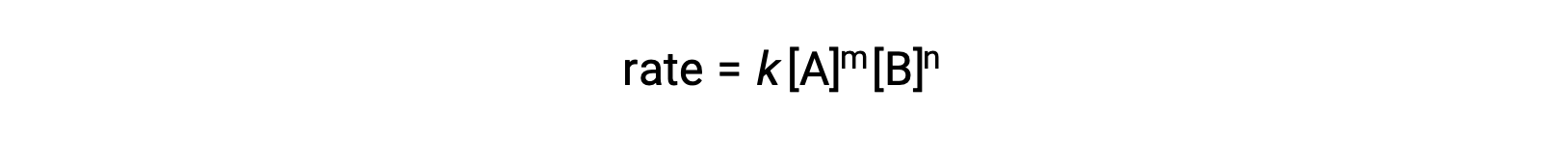
[A] и [B] представляют собой молярные концентрации реагенты, а k — константу скорости, которая характерна для конкретной реакции при определенной температуре.
Экспоненты m и n являются порядками реакции и обычно являются положительными целыми числами, хотя они могут быть дроби, отрицательными или нулевыми.
Константа скорости k и порядки реакции m и n определяются экспериментально путем наблюдения за изменением скорости реакции по мере изменения концентраций реагенты. Константа скорости k не зависит от концентраций реагент, но изменяется в зависимости от температуры.
В указаниях на реакцию в законе о ставке описывается математическая зависимость скорости от концентраций реагент. Ссылаясь на общий закон о ставке (Rate = k[A]m[B]n), реакция является порядком m относительно ПОРЯДКА A и n относительно B. например, если m = 1 и n = 2, Реакция является первой в порядке А и второй в B. Общий порядок реакции — это просто сумма ордеров для каждого реагент. Например, закон ставок здесь, реакция является третьим общим порядком (1 + 2 = 3).
Общий экспериментальный подход к определению норм внесения является методом начальных ставок. Этот метод включает в себя измерение скорости реакции для нескольких экспериментальных исследований, проведенных с использованием различных начальных концентраций реагент. Сравнение измеренных ставок для этих испытаний позволяет определить порядок действий и, впоследствии, константу ставок, которая вместе используется для формулирования закона ставок.
Законы о норме могут представлять дробные приказы для некоторых реагенты, а иногда при увеличении концентрации одного реагент происходит снижение скорости реакции. Важно отметить, что законы о частоте определяются только экспериментом и не могут быть надежно предсказаны стехиометрией реакции.
Порядок реакции определяет соотношение между скоростью реакции и концентрацией реагенты или продуктов.
• в реакции нулевого порядка концентрация реагенты не оказывает никакого влияния на скорость реакции, которая остается постоянной на протяжении всего процесса.
• в реакции первого порядка скорость реакции прямо и линейно пропорциональна изменению концентрации реагент. По мере снижения концентрации реагент скорость реакции также пропорционально уменьшается.
• в реакциях второго порядка или более высокого порядка скорость реакции пропорциональна экспоненциальному значению реагенты. Поэтому по мере развития реакции и снижения концентрации реагенты скорость реакции уменьшается экспоненциально.
Этот текст был адаптирован к Openstax, Химия 2е изд., раздел 12.3: Законы о тарифе.
