13.9:
Meccanismi di reazione
13.9:
Meccanismi di reazione
Le reazioni chimiche spesso si verificano in modo graduale, coinvolgendo due o più reazioni distinte che avvengono in una sequenza. Un’equazione equilibrata indica la specie reagente e la specie del prodotto, ma non rivela dettagli su come la reazione si verifica a livello molecolare. Il meccanismo di reazione (o percorso di reazione) fornisce dettagli sul processo preciso e passo dopo passo con cui si verifica una reazione.
Ad esempio, la decomposizione dell’ozono sembra seguire un meccanismo con due passaggi:
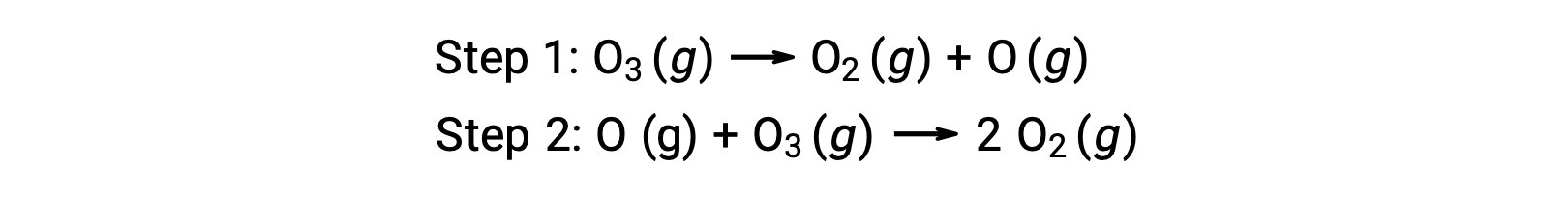
Ognuno dei passaggi di un meccanismo di reazione è chiamato reazione elementare. Queste reazioni elementari si verificano in sequenza, come rappresentato nelle equazioni di fase, e si sommano per produrre l’equazione chimica bilanciata che descrive la reazione complessiva:
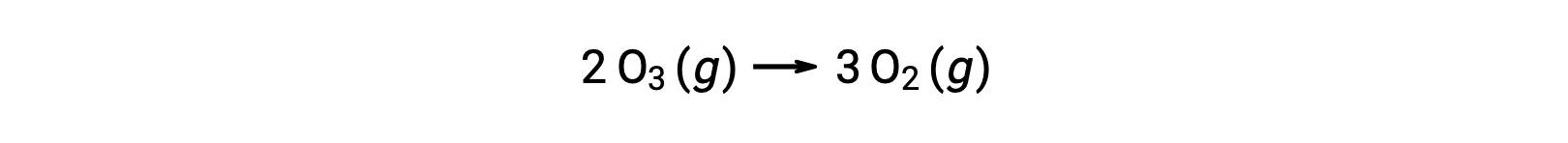
Si noti che l’atomo di ossigeno prodotto nel primo passaggio viene consumato durante il secondo e non appare come prodotto nella reazione complessiva. Tali specie che vengono prodotte in un unico passaggio e consumate in una successiva sono chiamate intermedie di reazione.
Mentre l’equazione di reazione complessiva indica che due molecole di ozono reagiscono per dare tre molecole di ossigeno, il meccanismo di reazione effettivo non comporta la collisione diretta e la reazione di due molecole di ozono. Invece, una O 3 sidecompone per produrre O2 e un atomo di ossigeno, e una seconda molecola O3 reagisce successivamente con l’atomo di ossigeno per produrre altre due molecole di O2.
A differenza delle equazioni bilanciate che rappresentano una reazione complessiva, le equazioni per le reazioni elementari sono rappresentazioni esplicite del cambiamento chimico. Un’equazione di reazione elementare descrive il reagente o i reagenti effettivi sottoposti a rottura/fabbricazione del legame e il prodotto o i prodotti formati. Quindi, la legge del tasso per una reazione elementare può essere derivata direttamente dalla sua equazione chimica bilanciata. Tuttavia, questo non è il caso delle reazioni chimiche tipiche, per le quali le leggi sui tassi possono essere determinate in modo affidabile solo attraverso la sperimentazione.
Reazioni elementari unimolecolari
La molecolarità di una reazione elementare è il numero di specie reagenti (atomi, molecole o ioni). Ad esempio, una reazione unimolecolare comporta la reazione di un singolo reagente per produrre una o più molecole di prodotto:

La legge del tasso per una reazione unimolecolare è di primo ordine; tasso = k [A].
Una reazione unimolecolare può essere una delle numerose reazioni elementari in un complesso meccanismo di reazione. Ad esempio, la reazione (O3 (g) → O2 (g) + O) illustra una reazione elementare unimolecolare che si verifica come parte di un meccanismo di reazione in due gradi. Tuttavia, alcune reazioni unimolecolari possono essere l’unico passo di un meccanismo di reazione a un singolo passaggio. (In altre parole, una reazione “globale” può anche essere una reazione elementare in alcuni casi.) Ad esempio, la decomposizione in fase gassosa del ciclobutano, C4H8, in etilene, C2H4, è rappresentata dall’equazione chimica:
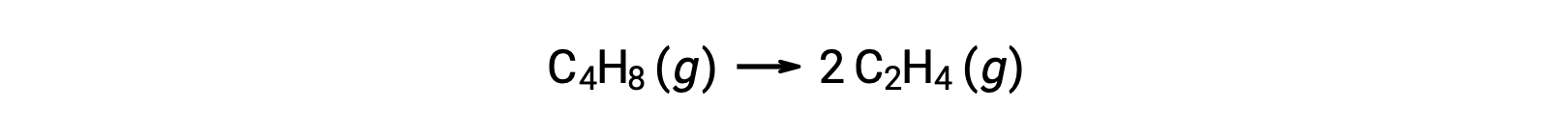
Questa equazione rappresenta la reazione complessiva, descrivendo un processo elementare unimolecolare. La legge del tasso prevista da questa equazione, supponendo che sia una reazione elementare, risulta essere la stessa della legge del tasso derivata sperimentalmente per la reazione complessiva, mostrando il comportamento del primo ordine:
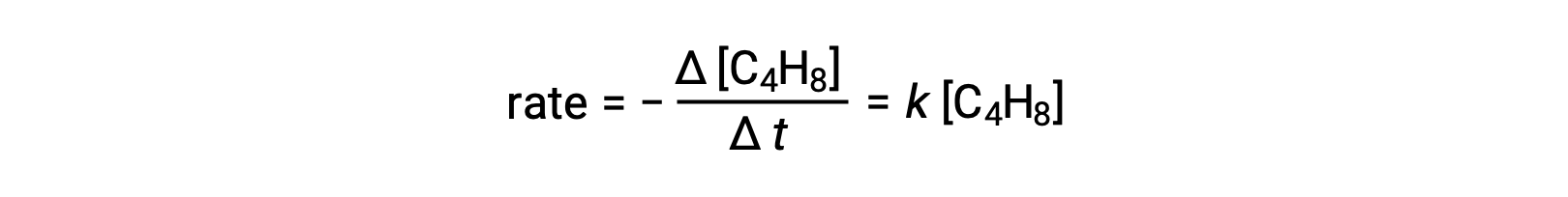
Questo accordo tra le leggi sui tassi osservate e previste indica che il processo unimolecolare e monostaglio proposto è un meccanismo ragionevole per la reazione butadiene.
Reazioni elementari bimolecolari
Una reazione bimolecolare coinvolge due specie reagenti. Per esempio:
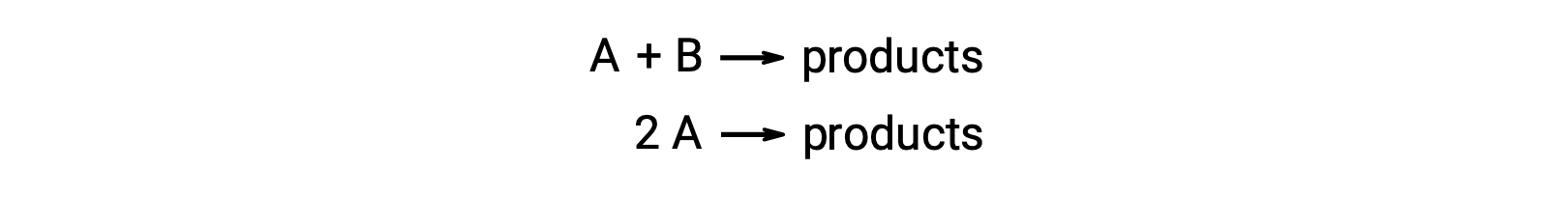
Nel primo tipo, dove le due molecole reagenti sono diverse, la legge del tasso è di primo ordine in A e di primo ordine in B (secondo ordine complessivo)
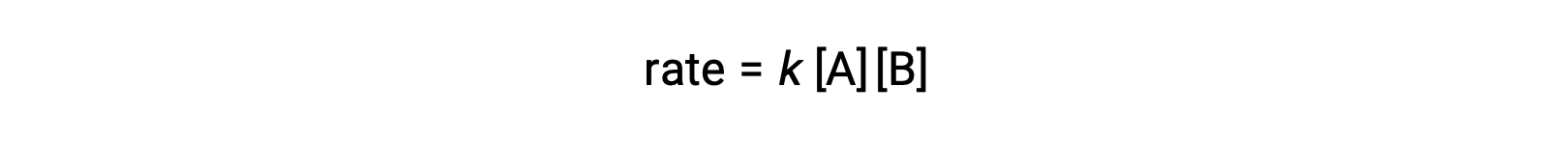
Nel secondo tipo, in cui due molecole identiche collidono e reagiscono, la legge dei tassi è di secondo ordine in A:
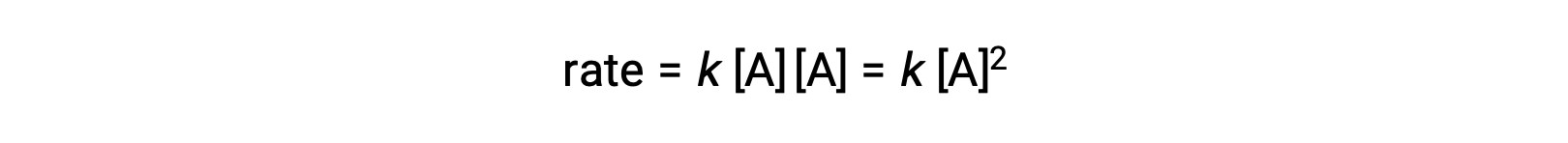
Alcune reazioni chimiche si verificano da meccanismi che consistono in una singola reazione elementare bimolecolare. Un esempio è la reazione del biossido di azoto con monossido di carbonio:
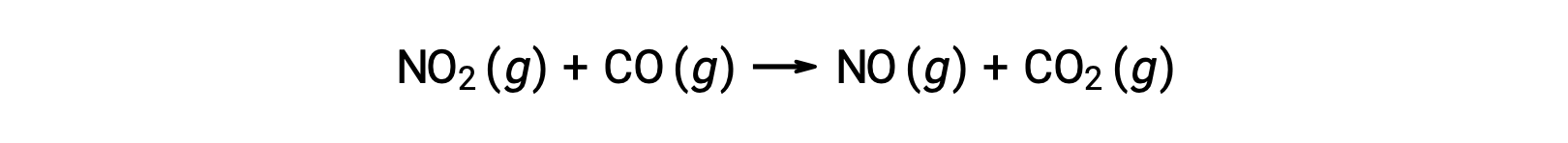
Le reazioni elementari bimolecolari possono anche essere coinvolte come passaggi in un meccanismo di reazione multistep. La reazione dell’ossigeno atomico con l’ozono è il secondo passo di un meccanismo di decomposizione dell’ozono in due gradi:
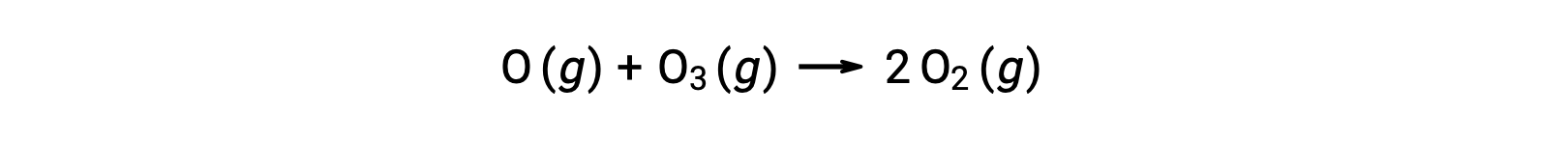
Reazioni elementari termolecolari
Una reazione termolecolare elementare comporta la collisione simultanea di tre atomi, molecole o ioni. Le reazioni elementari termolecolari sono rare perché la probabilità che tre particelle collidano simultaneamente è molto rara. Ci sono, tuttavia, alcune reazioni elementari termolecolari stabilite. La reazione dell’ossido nitrico con ossigeno sembra coinvolgere passaggi termolecolari:
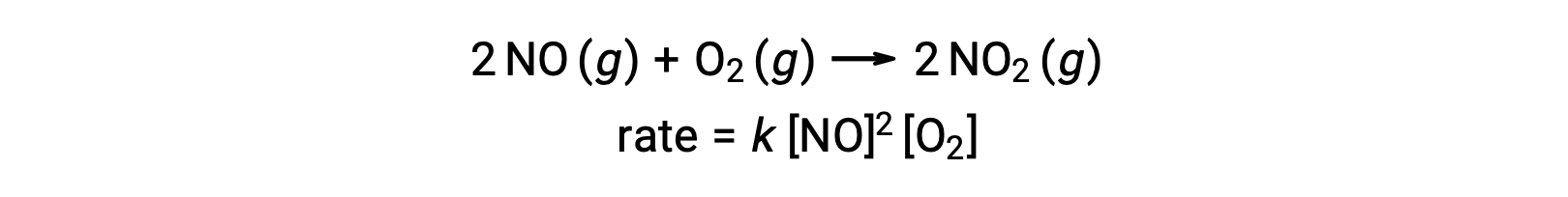
Allo stesso modo, la reazione dell’ossido nitrico con cloro sembra coinvolgere passaggi termolecolari:
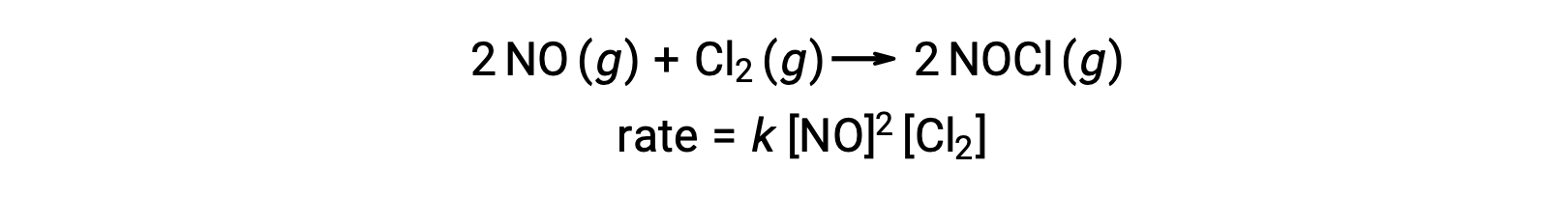
Spesso uno dei passaggi elementari in un meccanismo di reazione multistep è significativamente più lento degli altri. Poiché una reazione non può procedere più velocemente del suo passo più lento, questo passaggio limiterà la velocità con cui si verifica la reazione complessiva. Il passo elementare più lento è quindi chiamato passo limitante della velocità (o passo che determina la velocità) della reazione.
Questo testo è adattato da Openstax, Chemistry 2e, 12.6: Reaction Mechanisms.
