13.9:
反応メカニズム
13.9:
反応メカニズム
化学反応は多くの場合、2つ以上の異なる反応が連続して起こり、段階的に進行します。化学平衡式は反応種と生成種を含むが、反応がどのようにして起こるのか、分子レベルでの詳細はわかりません。一方、反応機構(または反応経路)は、反応がどのようにして起こるのかを段階的に詳細に示したものです。
例えば、オゾンの分解は、2つのステップからなるメカニズムに従っているように見えます。
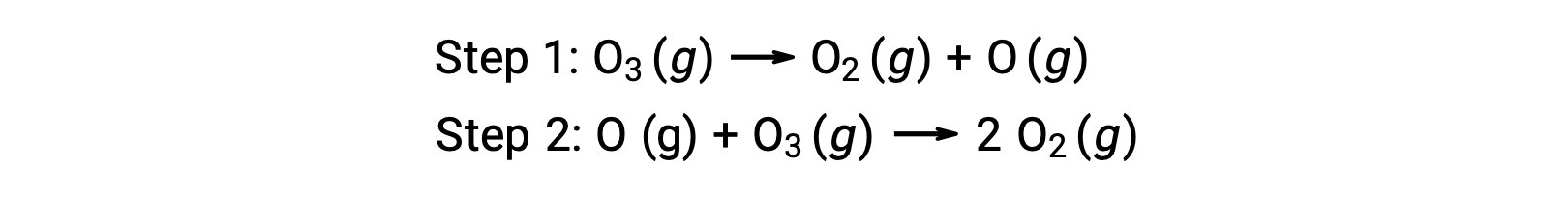
反応機構を構成する各ステップを素反応と呼びます。これらの素反応は、ステップ式で表されるように順番に起こり、それらを合計すると、全体の反応を表す平衡化学方程式が得られます。
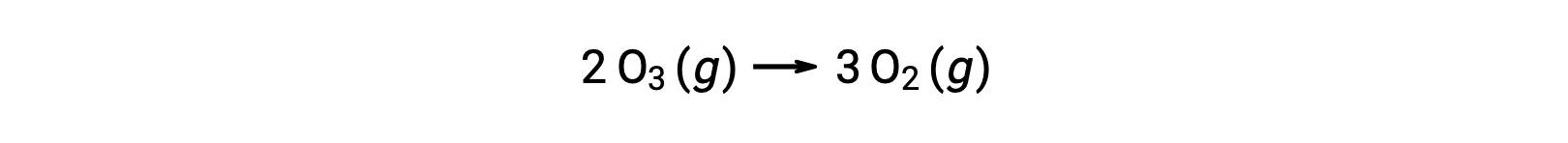
第1ステップで生成された酸素原子は第2ステップで消費され、全体の反応では生成物として現れないことに注意する必要があります。このように、ある段階で生成され、次の段階で消費される化学種を「反応中間体」と呼びます。
全体の反応式では、2つのオゾン分子が反応して3つの酸素分子を生成するように見えるが、実際の反応メカニズムでは、2つのオゾン分子が直接衝突して反応するわけではありません。実際には、1つのO3が分解してO2と酸素原子を生成し、続いて2つ目のO3分子が酸素原子と反応することでさらに2つのO2分子を生成します。
全体の反応を表す化学平衡式とは異なり、素反応式は詳細な化学変化を直接表しています。素反応式では、実際に結合の切断や生成を行っている反応物と、生成物が含まれます。したがって、素反応における反応速度則は、その化学平衡式から直接導き出すことができます。しかし、素反応が組み合わさった化学反応の場合はそうはいかず、実験によってのみ確実に反応速度を決定することができます。
単分子の素反応
素反応における分子性とは、反応種(原子、分子、イオン)の数を指します。例えば、単分子反応では、1つの反応物を反応させて1つ以上の分子の生成物ができます。

単分子反応の速度則は一次であり、”反応速度” = k [A]です。
単分子反応は、複雑な反応機構における素反応の一つである場合があります。例えば、(O3 (g) → O2 (g) + O)という反応は、2段階の反応機構の一部として起こる単分子の素反応を示しています。しかし、単分子反応の中には、1段階の反応機構の唯一のステップとなるものもあります。(つまり、全体の反応が一つの素反応で表される場合。) 例えば、シクロブタン(C4H8)が気相でエチレン(C2H4)に分解される現象は、次の反応式で表されます。
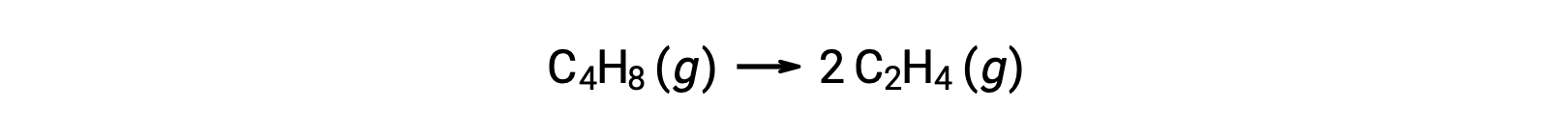
この式は反応全体を表し、単分子の素反応を記述しています。この式から予測される速度則は、素反応であると仮定すると、実験的に得られた反応全体の速度則と同じになり、一次の挙動を示します。
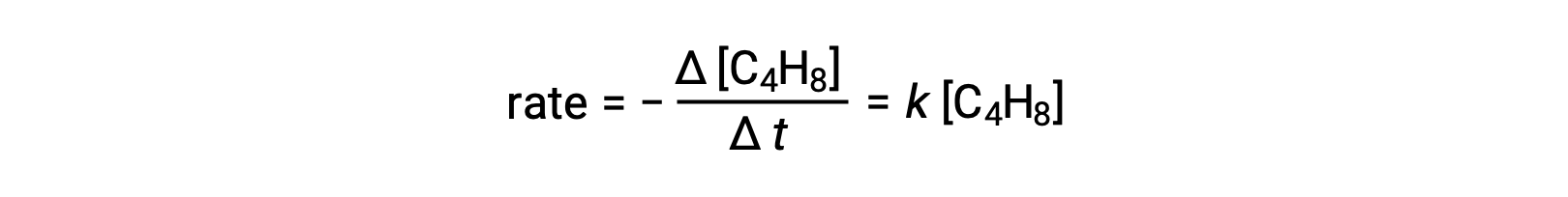
このように観察された速度則と予測された速度則が一致したことから、提案された単分子の1段階プロセスがブタジエン反応の合理的なメカニズムであることが示されました。
二分子の素反応
二分子反応は、2つの反応種を含む。例えば、以下のようなものです。
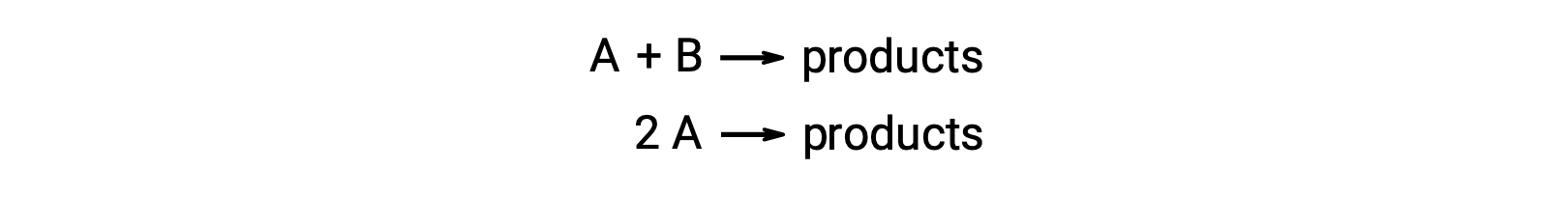
2つの反応分子が異なる1つ目のタイプでは、速度則はAで1次、Bで1次(全体では2次)となります。
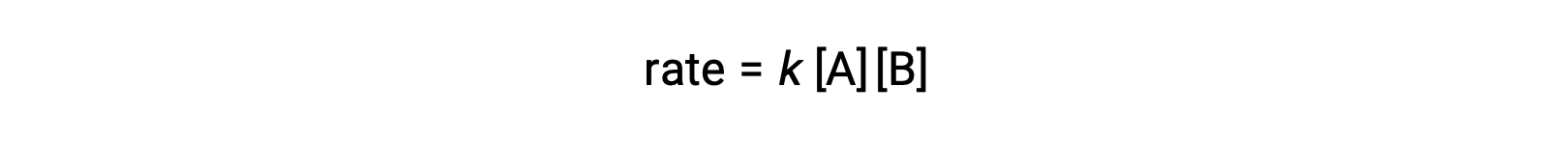
2つの同じ分子が衝突して反応する2つ目のタイプでは、速度則はAの2次になります。
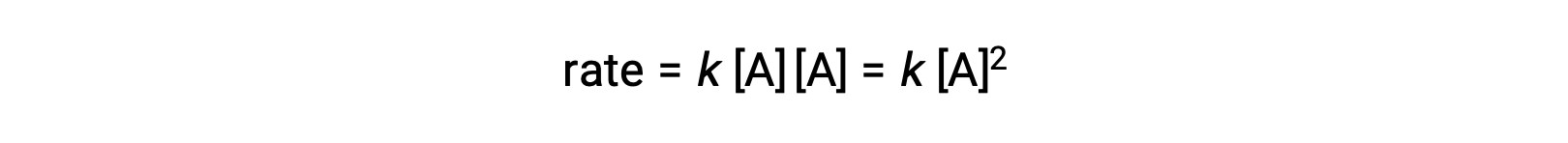
化学反応の中には、1つの二分子素反応からなるメカニズムで起こるものがあります。その一例が、二酸化窒素と一酸化炭素の反応です。
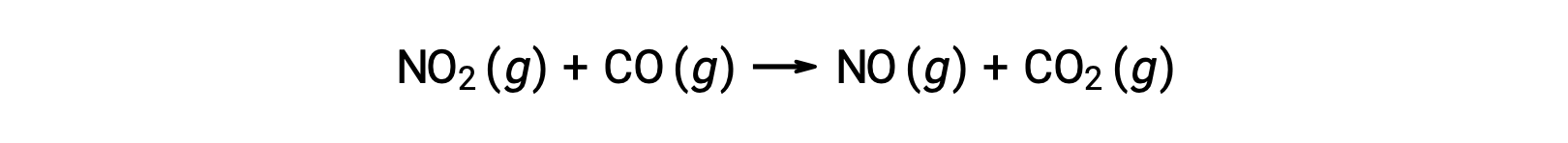
また、多段階の反応機構のステップとして、2分子の素反応が関与することもあります。原子状酸素とオゾンの反応は、2段階のオゾン分解メカニズムにおける第2段階にあたます。
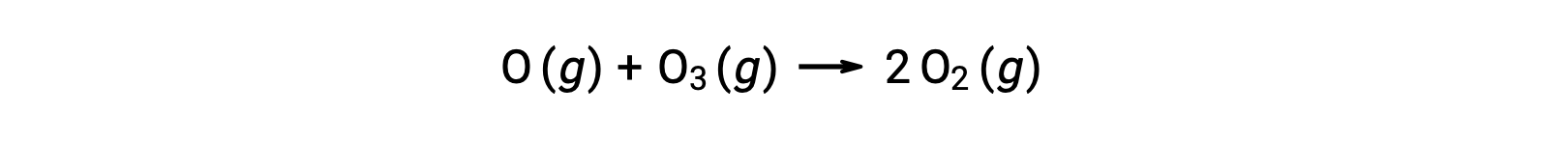
三分子の素反応
3つの原子、分子、イオンが同時に衝突するのが「3分子素反応」です。3つの粒子が同時に衝突する確率は非常に低いため、3分子素反応は一般的ではありません。しかし、いくつかの既に知られた3分子素反応があります。一酸化窒素と酸素の反応には、3分子素反応が関与したステップが含まれています。
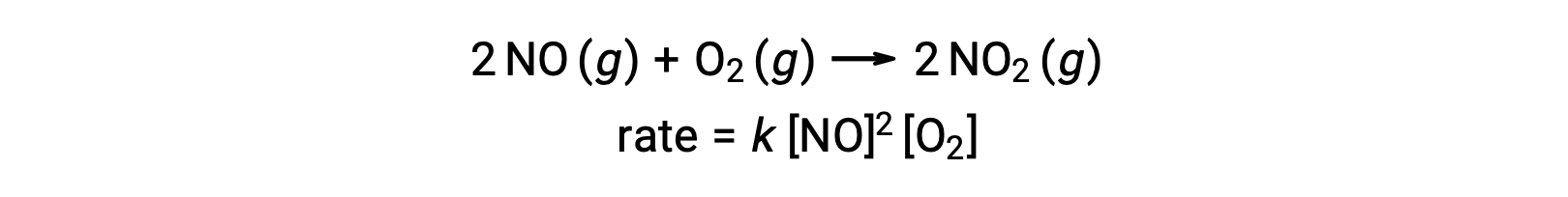
同様に、一酸化窒素と塩素の反応には、3分子素反応が関与したステップが含まれていると考えられています。
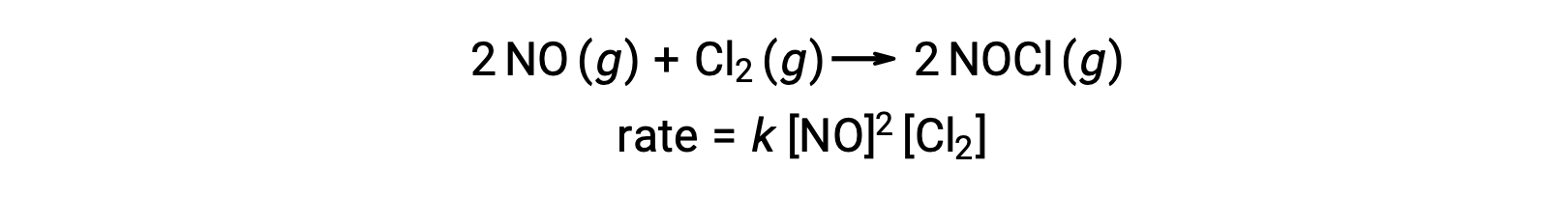
多段階の反応機構では、素反応の1つが他のステップにおける素反応よりも著しく遅いことがよくあります。反応は最も遅いステップよりも速く進むことはできないため、このステップは全体の反応が起こる速度を制限します。そのため、最も遅い基本ステップは、反応の律速段階と呼ばれます。
上記の文章は以下から引用しました。 Openstax, Chemistry 2e, 12.6: Reaction Mechanisms.
