13.9:
Reaksiyon Mekanizmaları
13.9:
Reaksiyon Mekanizmaları
Kimyasal reaksiyonlar, genellikle, bir dizide yer alan iki veya daha fazla farklı reaksiyonu içeren aşamalı bir şekilde meydana gelir. Dengeli bir denklem, reaksiyona giren türleri ve ürün türlerini gösterir, ancak reaksiyonun moleküler düzeyde nasıl gerçekleştiğine dair hiçbir ayrıntı vermez. Reaksiyon mekanizması (veya reaksiyon yolu), bir reaksiyonun meydana geldiği kesin, adım adım süreçle ilgili ayrıntıları sunar.
Örneğin, ozonun ayrışması iki aşamalı bir mekanizmayı izliyor gibi görünmektedir:</p
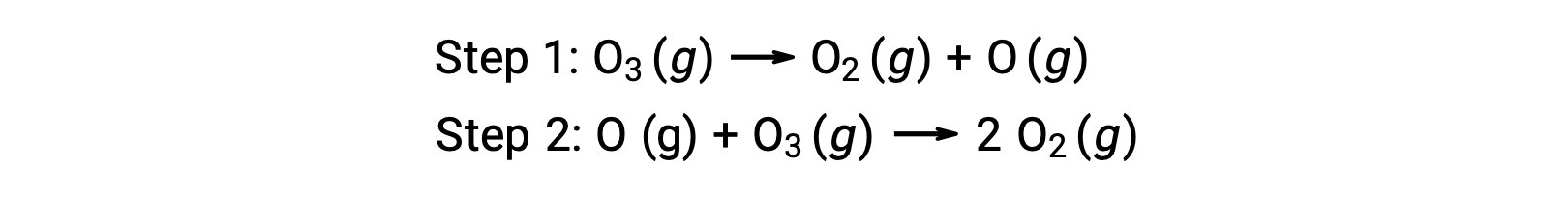
Bir reaksiyon mekanizmasındaki adımların her birine temel reaksiyon denir. Bu temel reaksiyonlar, adım denklemlerinde gösterildiği gibi sırayla gerçekleşir ve toplam reaksiyonu açıklayan dengeli kimyasal denklemi vermek için toplanır:
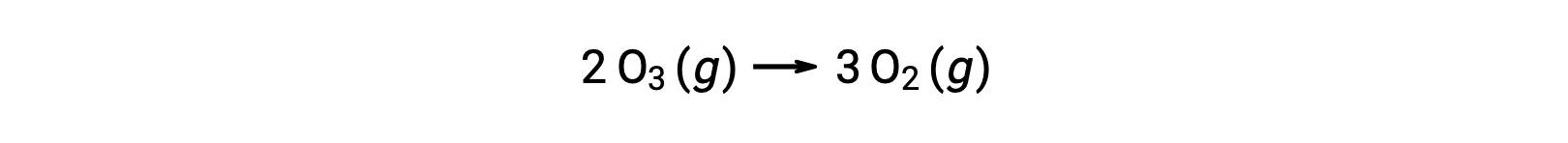
İlk aşamada üretilen oksijen atomunun ikinci aşamada tüketildiğine ve genel reaksiyonda bir ürün olarak görünmediğine dikkat edin. Bir aşamada üretilen ve sonraki aşamada tüketilen bu tür türlere reaksiyon ara ürünleri denir.
Genel reaksiyon denklemi, iki ozon molekülünün üç oksijen molekülü verecek şekilde reaksiyona girdiğini gösterirken, gerçek reaksiyon mekanizması iki ozon molekülünün doğrudan çarpışmasını ve reaksiyonunu içermez. Bunun yerine, bir O3 parçalanarak O2 ve bir oksijen atomu verir ve ikinci bir O3 molekülü daha sonra oksijen atomu ile reaksiyona girerek iki ek O2 molekülü verir.
Genel bir reaksiyonu temsil eden dengeli denklemlerin aksine, temel reaksiyonlar için denklemler kimyasal değişimin açık temsilleridir. Temel bir reaksiyon denklemi, bağ kırma/yapımına uğrayan gerçek reaktan(lar) ı ve oluşan ürün(ler) i gösterir. Bu nedenle, bir temel reaksiyon için hız yasası, doğrudan dengeli kimyasal denkleminden türetilebilir. Bununla birlikte, hız yasalarının yalnızca deney yoluyla güvenilir bir şekilde belirlenebileceği tipik kimyasal reaksiyonlar için durum böyle değildir.
Tek Moleküllü Temel Reaksiyonlar
Temel bir reaksiyonun molekülerliği, reaktan türlerin (atomlar, moleküller veya iyonlar) sayısıdır. Örneğin, tek moleküllü bir reaksiyon, bir veya daha fazla ürün molekülü üretmek için tek bir reaktantın reaksiyonunu içerir:

Tek moleküllü bir reaksiyon için oran yasası birinci dereceden; hız = k [A].
Tek moleküllü bir reaksiyon, karmaşık bir reaksiyon mekanizmasındaki birkaç temel reaksiyondan biri olabilir. Örneğin, (O3 (g) → O2 (g) + O) reaksiyonu, iki aşamalı bir reaksiyon mekanizmasının bir parçası olarak meydana gelen tek moleküllü bir temel reaksiyonu gösterir. Bununla birlikte, bazı tek moleküllü reaksiyonlar, tek adımlı reaksiyon mekanizmasının tek adımı olabilir. (Başka bir deyişle, “genel” bir reaksiyon, bazı durumlarda temel bir reaksiyon da olabilir.) Örneğin, siklobütan C4H8‘in etilen C2H4‘e gaz fazında ayrışması kimyasal denklemle temsil edilir:
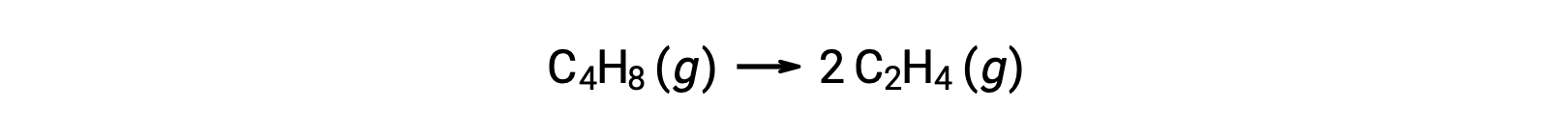
Bu denklem, tek moleküllü bir temel süreci tanımlayan genel reaksiyonu temsil eder. Bu denklemden tahmin edilen oran yasası, bunun temel bir reaksiyon olduğunu varsayarsak, birinci dereceden davranışı gösteren, genel reaksiyon için deneysel olarak türetilen oran yasası ile aynıdır:
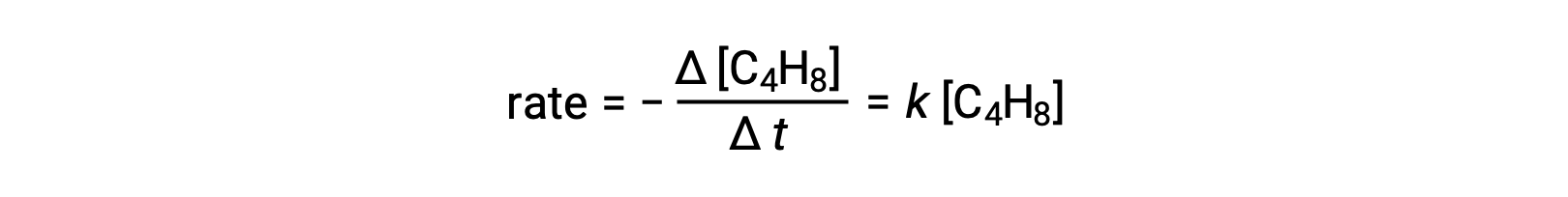
Gözlemlenen ve tahmin edilen hız yasaları arasındaki bu anlaşma, önerilen tek moleküllü tek aşamalı sürecin bütadien reaksiyonu için makul bir mekanizma olduğunu gösterir.
Bimoleküler Temel Reaksiyonlar
Bimoleküler bir reaksiyon, iki reaktan türü içerir. Örneğin:
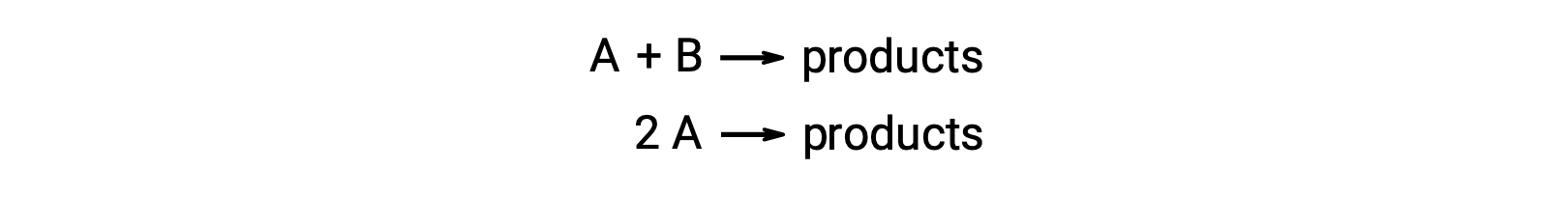
İki reaktan molekülün farklı olduğu birinci tipte, oran yasası A’da birinci dereceden ve B‘de birinci derecedendir (genel olarak ikinci dereceden).
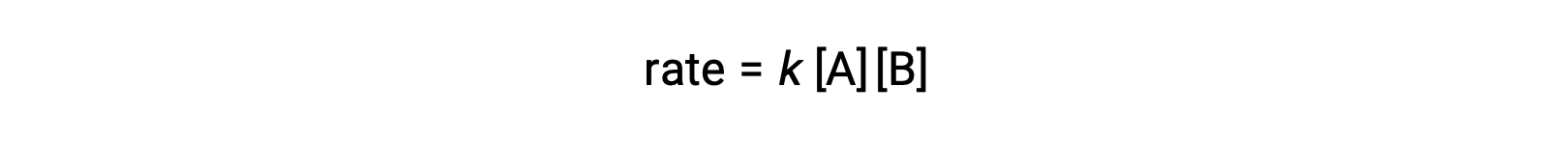
İki özdeş molekülün çarpıştığı ve reaksiyona girdiği ikinci türde, hız yasası A‘da ikinci derecedir:
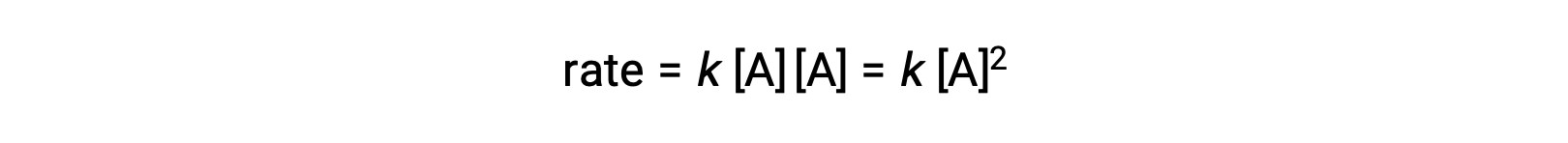
Bazı kimyasal reaksiyonlar, tek bir bimoleküler temel reaksiyondan oluşan mekanizmalar tarafından meydana gelir. Bir örnek, nitrojen dioksitin karbon monoksit ile reaksiyonudur:
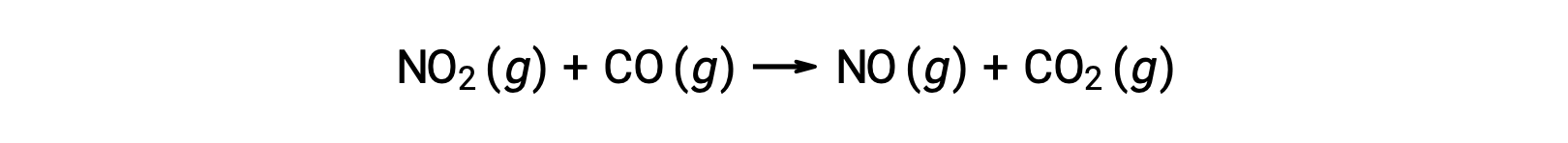
Bimoleküler temel reaksiyonlar, çok adımlı bir reaksiyon mekanizmasında adımlar olarak da yer alabilir. Atomik oksijenin ozonla reaksiyonu, iki aşamalı bir ozon ayrıştırma mekanizmasının ikinci adımıdır:
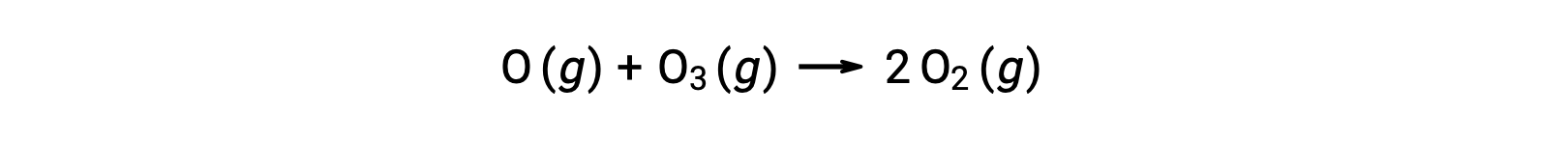
Termoleküler Temel Reaksiyonlar
Temel bir termoleküler reaksiyon, üç atomun, molekülün veya iyonun aynı anda çarpışmasını içerir. Termoleküler temel reaksiyonlar nadirdir çünkü aynı anda üç parçacığın çarpışma olasılığı çok nadirdir. Bununla birlikte, birkaç yerleşik termoleküler temel reaksiyon vardır. Nitrik oksidin oksijenle reaksiyonu, termoleküler aşamaları içeriyor gibi görünmektedir:
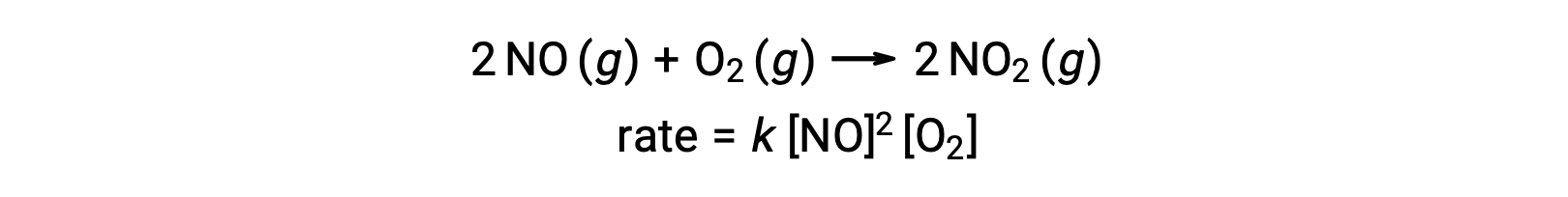
Benzer şekilde, nitrik oksidin klor ile reaksiyonu termoleküler aşamaları içeriyor gibi görünmektedir:
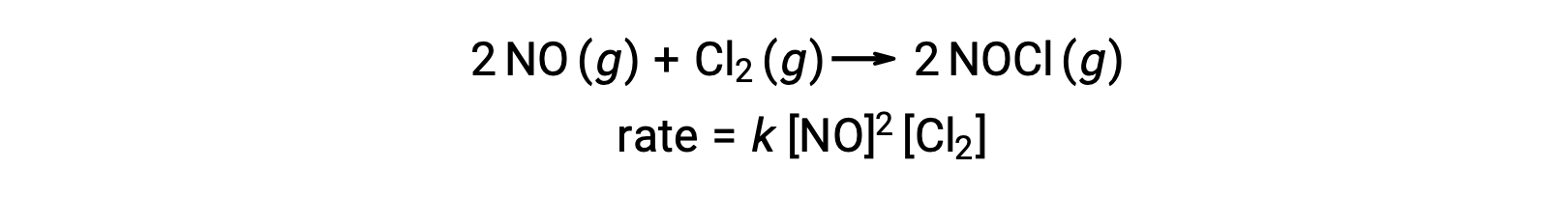
Çoğu zaman, çok adımlı bir reaksiyon mekanizmasındaki temel adımlardan biri, diğerlerinden önemli ölçüde daha yavaştır. Bir reaksiyon en yavaş adımından daha hızlı ilerleyemeyeceği için, bu adım genel reaksiyonun meydana geldiği hızı sınırlayacaktır. Bu nedenle en yavaş temel adım, reaksiyonun hız kısıtlayıcı adımı (veya hız belirleyici adımı) olarak adlandırılır.
Bu metin bu kaynaktan uyarlanmıştır:Openstax, Chemistry 2e, 12.6: Reaction Mechanisms.
