13.9:
آليات التفاعل
13.9:
آليات التفاعل
غالباً ما تحدث التفاعلات الكيميائية بطريقة متدرجة، تتضمن تفاعلين مميزين أو أكثر تحدث في تسلسل. تشير المعادلة المتوازنة إلى الأنواع المتفاعلة وأنواع المنتجات، ولكنها لا تكشف عن أي تفاصيل حول كيفية حدوث التفاعل على المستوى الجزيئي. توفر آلية التفاعل (أو مسار التفاعل) تفاصيل تتعلق بالعملية الدقيقة خطوة بخطوة التي يحدث بها التفاعل.
على سبيل المثال، يبدو أن تحلل الأوزون يتبع آلية ذات خطوتين:
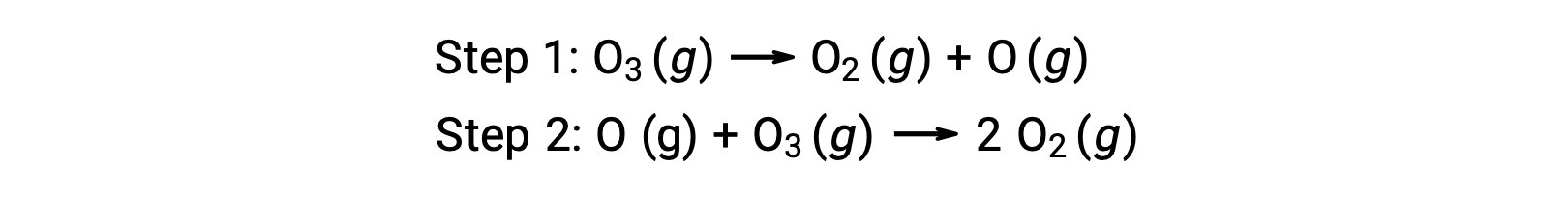
تسمى كل خطوة من خطوات آلية التفاعل تفاعل أولي. تحدث هذه التفاعلات الأولية بالتسلسل، كما هو موضح في معادلات الخطوة، وهي تُجمع لتنتج المعادلة الكيميائية المتوازنة التي تصف التفاعل الكلي:
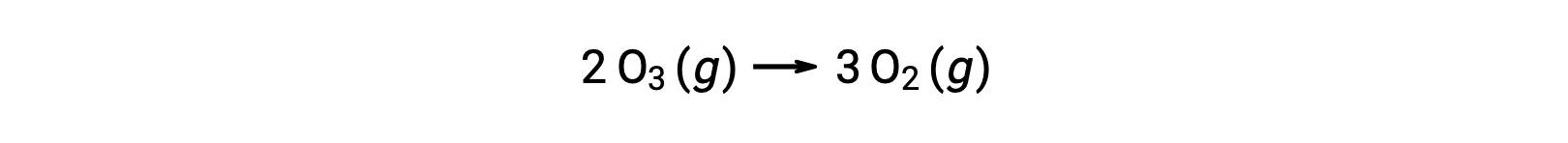
لاحظ أن ذرة الأكسجين الناتجة في الخطوة الأولى يتم استهلاكها خلال الثانية ولا تظهر كمنتج في التفاعل الكلي. تسمى هذه الأنواع التي يتم إنتاجها في خطوة واحدة واستهلاكها في خطوة لاحقة بمواد وسيطة.
بينما تشير معادلة التفاعل الكلية إلى أن جزيئي أوزون يتفاعلان لإعطاء ثلاثة جزيئات أكسجين، فإن آلية التفاعل الفعلية لا تتضمن التصادم المباشر ورد فعل جزيئي أوزون. بدلاً من ذلك، يتحلل واحد من O3 لينتج O2 وذرة من الأكسجين، وتتفاعل جزيئة ثانية من O3 لاحقًا مع ذرة الأكسجين لينتج عن ذلك جزيئتين إضافيتين من O2 .
على عكس المعادلات المتوازنة التي تمثل تفاعلاً كلياً، فإن معادلات التفاعلات الأولية هي تمثيلات صريحة للتغير الكيميائي. تصور معادلة التفاعل الأولية المتفاعل (المتفاعلات) الفعلية التي تخضع لكسر/صنع الرابطة، والمنتج (المنتجات) المتكونة. وبالتالي، يمكن اشتقاق قانون معدل التفاعل الأولي مباشرة من معادلته الكيميائية المتوازنة. ومع ذلك، ليس هذا هو الحال بالنسبة للتفاعلات الكيميائية النموذجية، حيث يمكن تحديد قوانين المعدل بشكل موثوق فقط من خلال التجارب.
التفاعلات الأولية أحادية الجزيء
إن جزيئية التفاعل الأولي هي عدد الأنواع المتفاعلة (الذرات أو الجزيئات أو الأيونات). على سبيل المثال، يتضمن التفاعل أحادي الجزيء تفاعل مفاعل واحد لإنتاج جزيء واحد أو أكثر من المنتج:

قانون معدل التفاعل أحادي الجزيء هو معدّل من الدرجة الأولى؛ المعدّل = k [A].
قد يكون التفاعل أحادي الجزيء واحداً من عدة تفاعلات أولية في آلية تفاعل معقدة. على سبيل المثال، التفاعل (O3 (g) → O2 (g) + O) يوضح تفاعلاً أولياً أحادي الجزيء يحدث كجزء من آلية تفاعل من خطوتين. ومع ذلك، قد تكون بعض التفاعلات أحادية الجزيء هي الخطوة الوحيدة لآلية التفاعل أحادية الخطوة. (بعبارة أخرى، قد يكون تفاعل “إجمالي” تفاعلاً أولياً أيضاً في بعض الحالات.) على سبيل المثال، تحلل الطور الغازي لـسيكلوبوتان C4H8، إلى الإيثيلين، C2H4، تمثلها المعادلة الكيميائية:
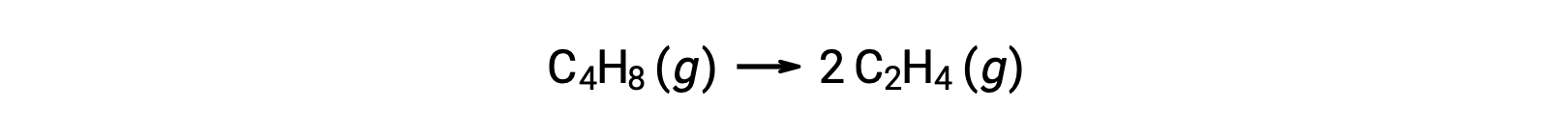
تمثل هذه المعادلة التفاعل الكلي، وتصف عملية أولية أحادية الجزيء. يتضح أن قانون المعدل المتوقع من هذه المعادلة، بافتراض أنه تفاعل أولي، هو نفسه قانون المعدل المشتق تجريبياً للتفاعل الكلي، والذي يوضح سلوك الدرجة الأولى للتفاعل:
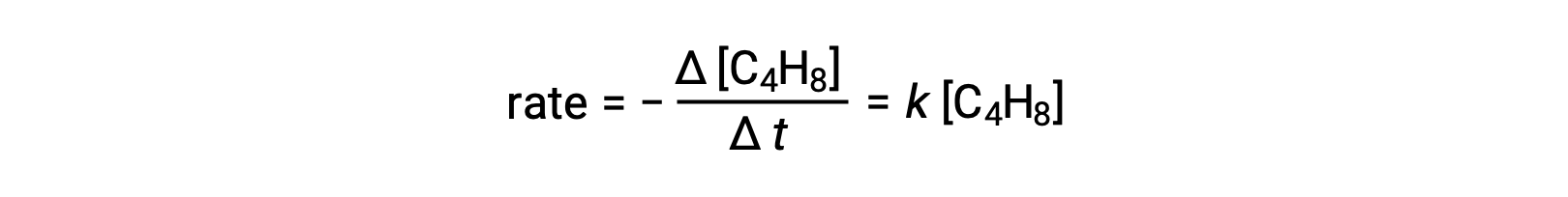
يشير هذا الاتفاق بين قوانين المعدل المُلاحظ والمتوقع إلى أن العملية المقترحة أحادية الجزيء أحادية الخطوة هي آلية معقولة لتفاعل البوتاديئين.
التفاعلات الأولية ثنائية الجزيئية
يتضمن التفاعل ثنائي الجزيء نوعين متفاعَلين. على سبيل المثال:
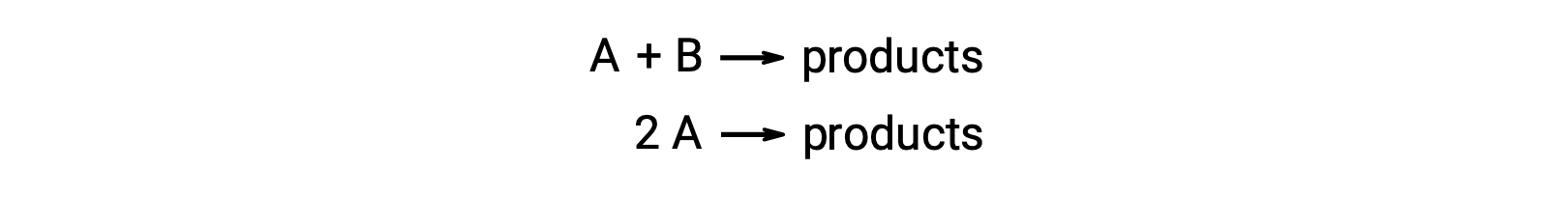
في النوع الأول، حيث يختلف جزيء المتفاعلان، يكون قانون المعدل من الدرجة الأولى في A ومن الدرجة الأولى في B (الترتيب الثاني بشكل عام)
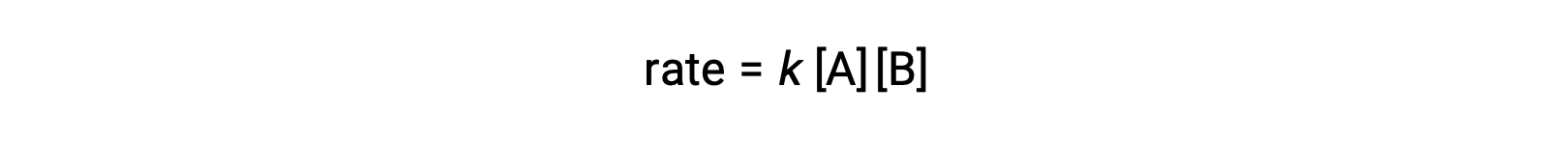
في النوع الثاني، حيث يصطدم جزيءان متطابقان ويتفاعلان ، يكون قانون المعدل هو الترتيب الثاني في A:
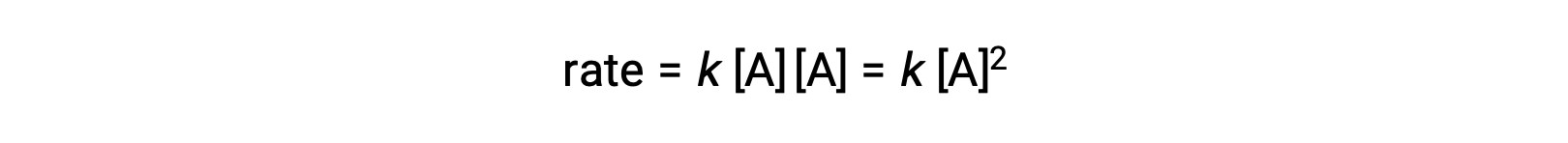
تحدث بعض التفاعلات الكيميائية بواسطة آليات تتكون من تفاعل أولي ثنائي الجزيء واحد. أحد الأمثلة على ذلك هو تفاعل ثاني أكسيد النيتروجين مع أول أكسيد الكربون:
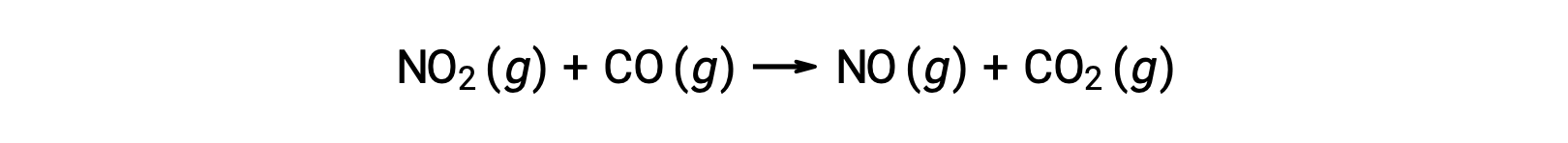
يمكن أيضاً تضمين التفاعلات الأولية ثنائية الجزيء كخطوات في آلية تفاعل متعددة الخطوات. تفاعل الأكسجين الذرّي مع الأوزون هو الخطوة الثانية لعملية تحلّل الأوزون والمكونة من خطوتين:
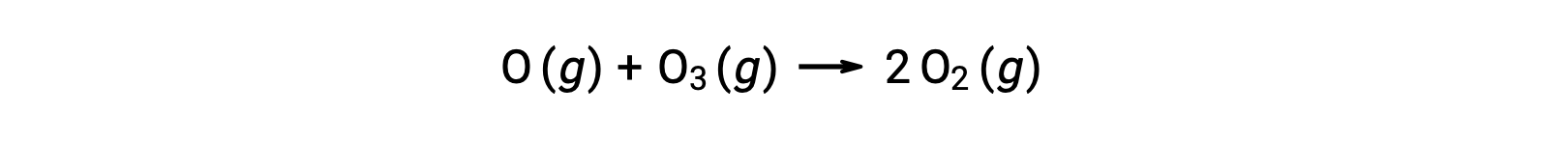
التفاعلات الأولية الجزيئية
يتضمن التفاعل الأولي الجزيئي التصادم المتزامن لثلاث ذرات أو جزيئات أو أيونات. التفاعلات الأولية الجزيئية غير شائعة لأن احتمال اصطدام ثلاث جسيمات في وقت واحد نادر جداً. ومع ذلك، هناك عدد قليل من التفاعلات الأولية الجزيئية النهائية. يبدو أن تفاعل أكسيد النيتريك مع الأكسجين يتضمن خطوات جزيئية نهائية:
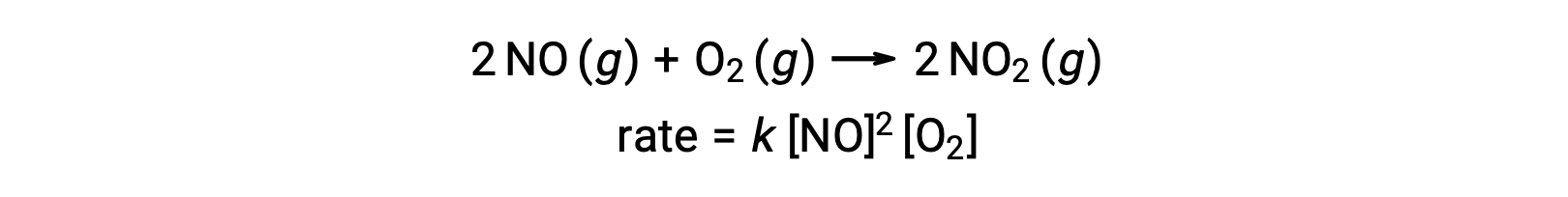
وبالمثل، يبدو أن تفاعل أكسيد النيتريك مع الكلور يتضمن خطوات جزيئية نهائية:
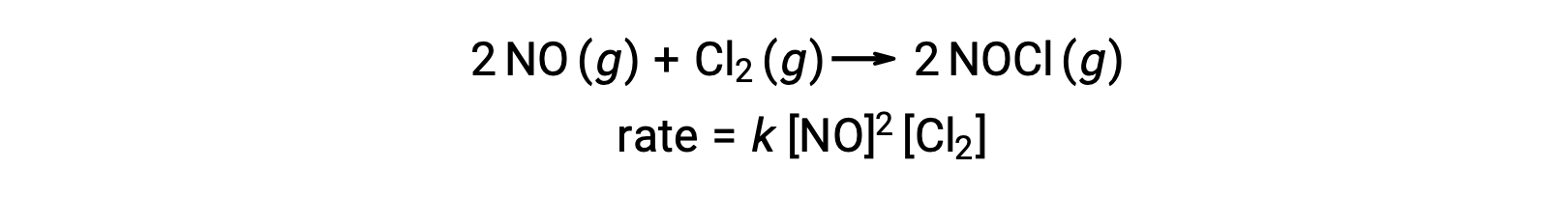
غالباً ما تكون إحدى الخطوات الأولية في آلية التفاعل متعدد الخطوات أبطأ بكثير من الخطوات الأخرى. نظراً لأن التفاعل لا يمكن أن يستمر بشكل أسرع من أبطأ خطواته، فإن هذه الخطوة ستحد من معدل حدوث التفاعل الكلي. ولذلك فإن أبطأ خطوة أولية تسمى خطوة تحديد المعدل (أو خطوة تحديد المعدل) للتفاعل.
هذا النص مقتبس من Openstax, Chemistry 2e, 12.6: Reaction Mechanisms.
