15.3:
El Agua: Un Ácido y Una Base de Bronsted-Lowry
15.3:
El Agua: Un Ácido y Una Base de Bronsted-Lowry
La reacción entre un ácido de Brønsted-Lowry y el agua se llama ionización ácida. Por ejemplo, cuando el fluoruro de hidrógeno se disuelve en el agua e ioniza, los protones se transfieren de las moléculas de fluoruro de hidrógeno a moléculas de agua, produciendo iones de hidronio e iones de fluoruro:
La ionización básica de una especie ocurre cuando acepta protones de las moléculas de agua. En el siguiente ejemplo, las moléculas de piridina, C5NH5, se someten a ionización de base cuando se disuelven en agua, produciendo iones de hidróxido y piridinio:
Las reacciones de ionización anteriores sugieren que el agua puede funcionar como una base (como en su reacción con fluoruro de hidrógeno) y como un ácido (como en su reacción con amoníaco). Las especies capaces de donar o aceptar protones se llaman anfipróticos, o más comúnmente, anfóteras, un término que puede ser utilizado para ácidos y bases por definiciones distintas a la de Brønsted-Lowry. Las ecuaciones a continuación muestran las dos posibles reacciones ácido-base para dos especies anfipróticas, el ión bicarbonato y el agua:
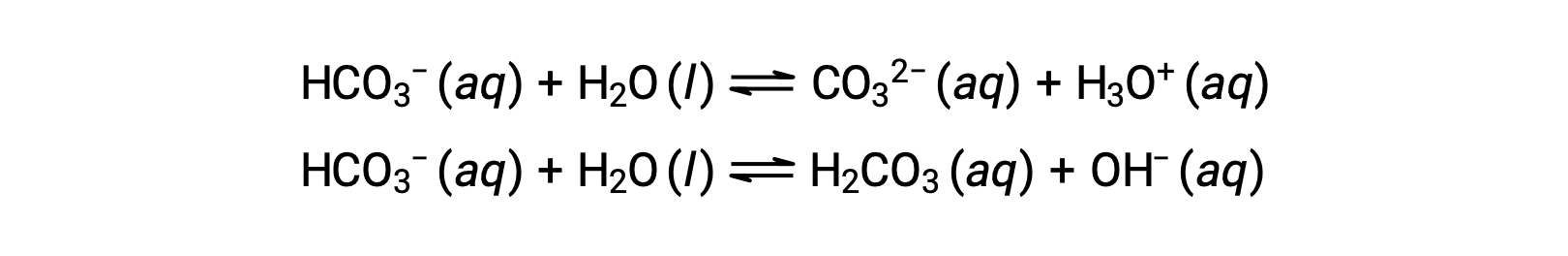
La primera ecuación representa la reacción del bicarbonato como ácido con el agua como base, mientras que la segunda representa la reacción del bicarbonato como base con el agua como ácido. Cuando se añade bicarbonato al agua, ambos equilibrios se establecen simultáneamente y la composición de la solución resultante puede determinarse mediante cálculos de equilibrio apropiados. En el estado líquido, las moléculas de una sustancia anfiprótica pueden reaccionar entre sí como se ilustra para el agua en las siguientes ecuaciones:
El proceso en el que moléculas semejantes reaccionan para formar iones se denomina autoionización. El agua líquida sufre una autoionización muy leve; a 25 °C, aproximadamente dos de cada mil millones de moléculas de agua se ionizan. El grado del proceso de autoionización del agua se refleja en el valor de su constante de equilibrio, la constante ion-producto del agua, KW:
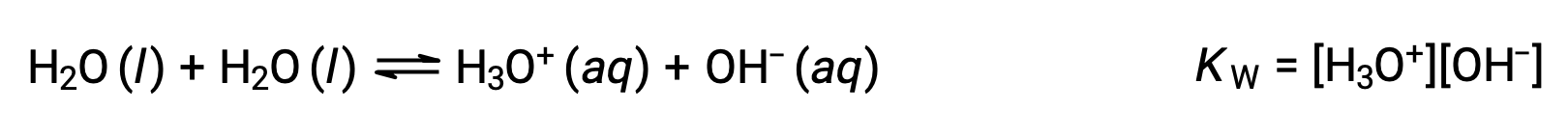
La ligera ionización del agua pura se refleja en el pequeño valor de la constante de equilibrio; a 25 °C, KW tiene un valor de 1,0 × 10−14.
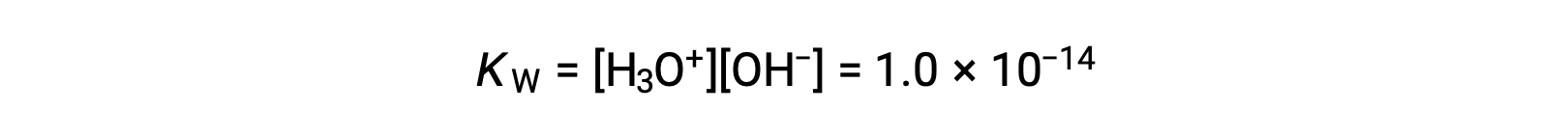
El proceso es endotérmico, por lo que el grado de ionización y las concentraciones resultantes de iones de hidronio e hidróxido aumentan con la temperatura. Por ejemplo, a 100 °C, el valor de KW es aproximadamente 5,6 × 10−13, aproximadamente 50 veces mayor que el valor a 25 °C.
La autoionización del agua produce el mismo número de iones de hidronio que de hidróxido. Por lo tanto, en agua pura a 25 °C:
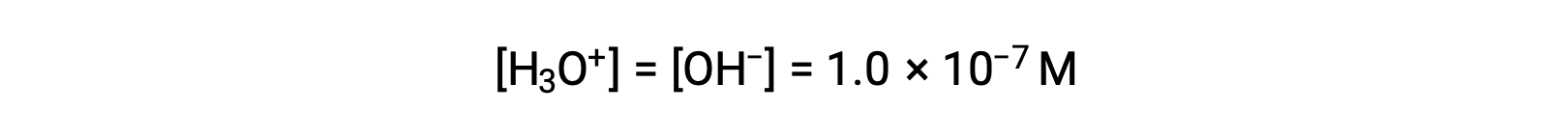
Las concentraciones de estos iones en una solución son a menudo determinantes críticos de las propiedades de la solución y de los comportamientos químicos de sus otros solutos, y se ha desarrollado un vocabulario específico para describir estas concentraciones en términos relativos. Una solución es neutra si contiene concentraciones iguales de iones hidronio e hidróxido; ácida si contiene una concentración mayor de iones hidronio que de iones hidróxido; y básica si contiene una concentración menor de iones hidronio que de iones hidróxido.
Resumen de relaciones para soluciones ácidas, básicas y neutras
| Clasificación | Concentraciones relativas de iones | PH a 25 °C. |
| ácido | [H3O+] > [OH−] | PH < 7 |
| neutro | [H3O+] < [OH−] | pH @ 7 |
Este texto está adaptado de Openstax, Química 2e, Sección 14.1: Ácidos y bases de Brønsted-Lowry, y Sección 14.2: pH y pOH.
