15.3:
水: 布朗斯特-劳里的酸和碱
15.3:
水: 布朗斯特-劳里的酸和碱
布朗斯特-劳里 酸与水之间的反应称为酸电离。 例如,当氟化氢溶解在水中并产生电离时,质子会从氟化氢分子转移到水分子,从而产生水合氢离子和氟化物离子:
当一种物种接受来自水分子的质子时,就会发生碱电离。 在以下示例中,当溶解在水中时,吡啶分子 C5NH5 会发生碱电离,从而产生氢氧化物和吡啶鎓离子:
前面的电离反应表明,水可能同时起碱 (如对氟化氢的反应) 和酸 (如对氨的反应) 的作用。 可以捐赠或接受质子的物种被称为两性的,或者更一般地称为苯丙二酸,一个术语可用于除 布朗斯特-劳里以外的酸和碱定义。 下面的方程式显示了两种可能的 酸-碱 反应,分别针对两种两性的物种,二碳酸盐离子和水:
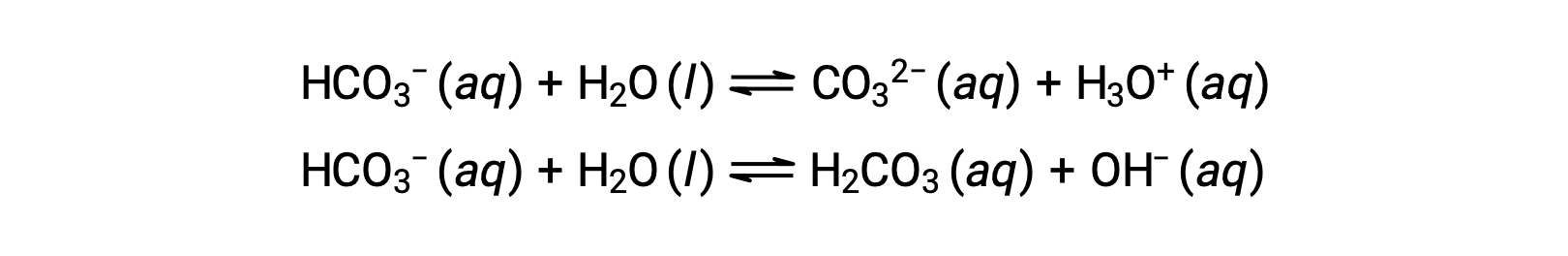
第一个方程表示二碳酸作为水的酸反应为碱,第二个表示二碳酸作为水作为酸的碱的反应。 当向水中添加碳酸氢盐时,这两种平衡都是同时建立的,由此产生的溶液的成分可以通过适当的平衡计算来确定。 在液体状态下,两性的物质的分子可以相互反应,如下方程中的水示例所示:
类似分子对产率离子反应的过程称为自电离。 液态水的电离作用非常小;在 25 °C 时,每十亿个水分子中大约有两个电离。 水自电离过程的范围反映在其平衡常数 (水的离子产物常数) 的值中, KW :
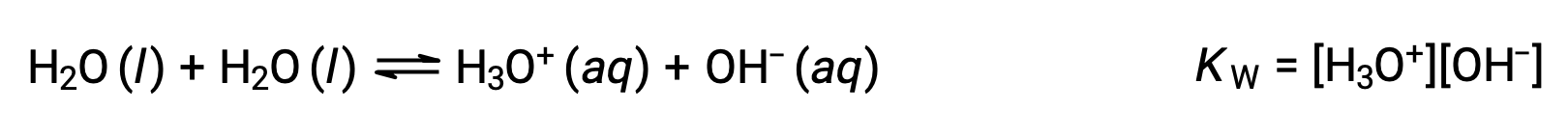
纯水的轻微电离反映在平衡常数的小值中;在 25 °C 时, KW 的值为 1.0 × 10−14。
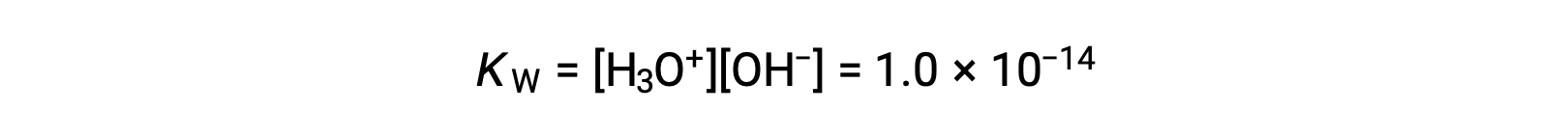
这一过程是吸热,因此电离的范围以及由此产生的水合氢离子和氢氧化物离子浓度随温度的升高而增加。 例如,在 100 °C 时, KW 的值约为 5.6 × 10−13 ,大约比 25 °C 时的值大 50 倍
水产率的自电离水合氢离子和氢氧化物离子数量相同。 因此,在 25 °C 的纯水中:
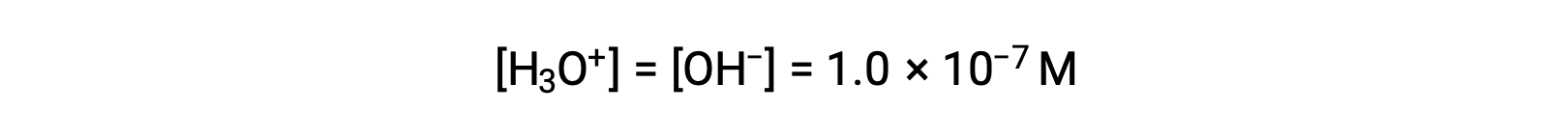
这些离子在溶液中的浓度通常是该溶液性质及其其他溶质的化学行为的关键决定因素,并已开发出特定词汇来相对描述这些浓度。 如果溶液中的水合氢离子和氢氧化物离子浓度相等,则它是中性的;如果它中的水合氢离子浓度大于氢氧化物离子,则它是酸性的;如果它中的水合氢离子浓度小于氢氧化物离子,则它是碱性的。
酸性,基本和中性溶液的关系概要
| 分类 | 相对离子浓度 | 25 °C 时的 pH 值 |
| 酸性 | [H3O+] > [H3O+] OH− | pH < 7 |
| 中立 | [H3O+] = [ OH− ] | pH = 7 |
| 基本 | [H3O+] < [ OH− ] | pH > 7 |
本文改编自 Openstax, 化学 2e, 第14.1节: 布朗斯特-劳里的酸和碱 , 和 第14.2节:pH值和pOH。
