17.6:
깁스 자유에너지
17.6:
깁스 자유에너지
열역학의 제2법칙을 사용하여 공정이 자발적인지 를 결정하는 과제 중 하나는 시스템에 대한 엔트로피 변경과 주변 환경에 대한 엔트로피 변화의 측정이 필요하다는 것입니다. 시스템 특성측면에서 정의된 새로운 열역학적 특성과 관련된 대안은 19세기 후반에 미국의 수학자 조시아 윌라드 깁스(Josiah Willard Gibbs)에 의해 도입되었습니다. 이 새로운 속성은 깁스 자유 에너지(G)(또는 단순히 자유 에너지)라고하며, 다음과 같은 시스템의 엔탈피와 엔트로피의 관점에서 정의됩니다 .
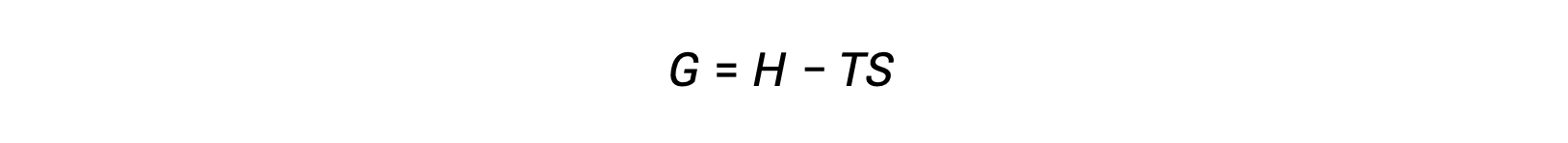
자유 에너지는 상태 기능이며, 일정한 온도 및 압력에서, 자유 에너지 변화(ΔG)는다음과 같이 표현될 수 있다.
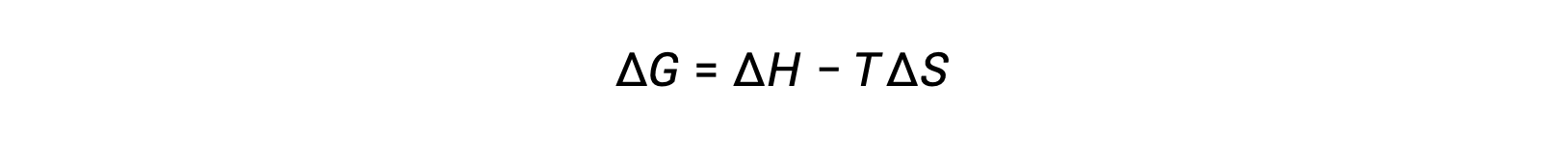
이 시스템 속성과 프로세스의 자발성 사이의 관계는 이전에 파생된 두 번째 법 표현을 회수하여 이해할 수 있습니다.
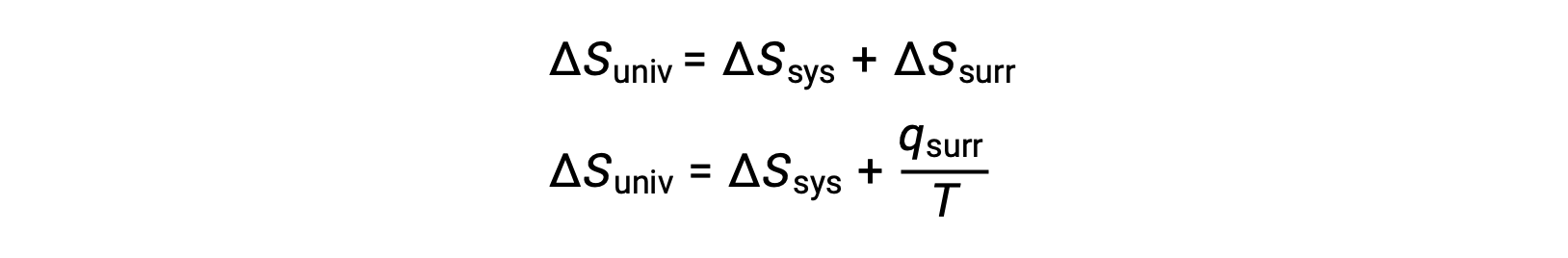
첫 번째 법은 qsurr = –qsys,그리고 일정한 압력 qsys = ΔH에서이 표현이 다음과 같이 다시 작성될 수 있도록 요구합니다.
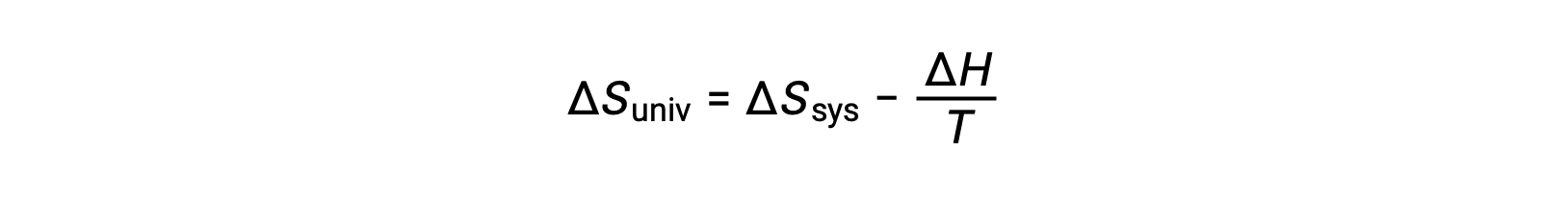
이 방정식의 양쪽을 곱 –T 및 재배열은 다음과 같은 수반합니다 .
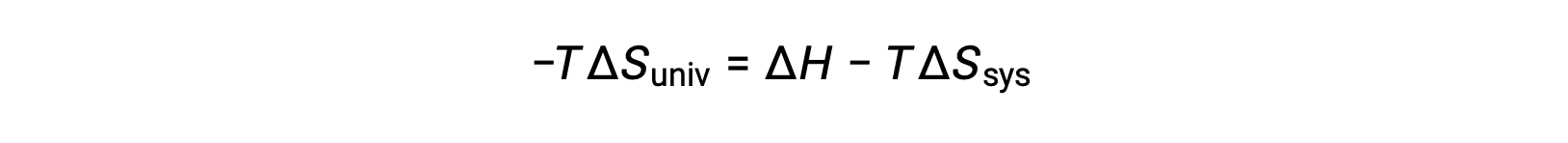
단순성을 위해 하위 스크립트 “sys”를 생략할 수 있으며 표현식은
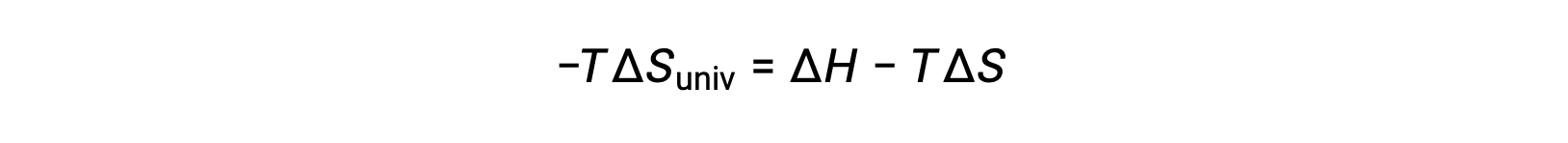
이 방정식을 무료 에너지 변경을 위해 이전 방정식과 비교하면 다음과 같은 관계가 표시됩니다.
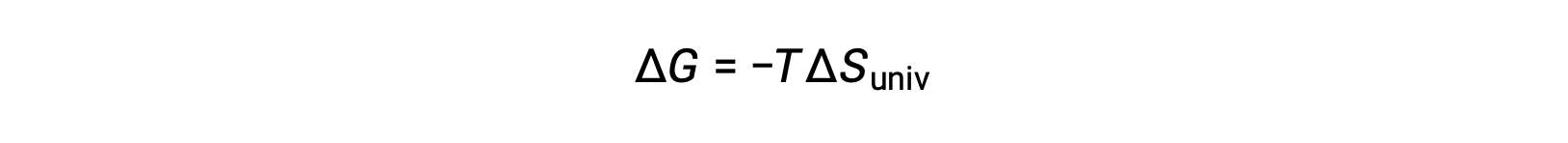
자유 에너지 변화는, 따라서, 프로세스의 자발성의 신뢰할 수있는 지표, 그것은 직접 이전에 식별 된 자발성 지표와 관련이 있기 때문에, ΔS대브.
ΔS가 0, ΔG & 0및 반응이 자발적인 경우.
ΔS가 0, ΔG > 0및 반응이 비자발적인 경우.
ΔS가 = 0, ΔG = 0및 반응이 평형에 있는 경우.
이 텍스트는 오픈 탁스, 화학 2e, 장 16.4에서 적응 : 무료 에너지.
