Overview
资料来源:亚历山大·金1,托尼娅·科尔皮茨1
1波士顿大学医学院微生物学系,国家新兴感染疾病实验室,波士顿,马萨诸塞州
转导是细菌之间的一种基因交换形式,它利用噬菌体或噬菌体,一种完全感染原核生物的病毒。这种形式的DNA转移,从一种细菌到另一种细菌通过噬菌体的方式,发现于1951年由诺顿·津德和约书亚·莱德勒格,谁称这个过程"转导"(1)。1915年,英国细菌学家弗雷德里克·特奥尔首次发现噬菌体,1917年由法裔加拿大微生物学家费利克斯·德赫勒(Felix d'Herelle)再次独立发现。自那时以来,这些噬菌体的结构和功能被广泛使用特征(3),将这些噬菌体分为两类。第一类是赖舍噬菌体,感染后在宿主细菌内繁殖,破坏细菌代谢,使细胞变流,并释放后代噬菌体(4)。由于这种抗菌活性和抗生素耐药细菌的日益流行,这些溶性噬菌体最近被证明是有用的抗生素替代治疗。第二类是溶源噬菌体,它可以通过溶源循环在宿主中繁殖,或者进入一种静止状态,其中它们的基因组被集成到宿主的基因组中(图1),这个过程称为溶质,具有噬菌体的能力生产在后世的诱导(4)。
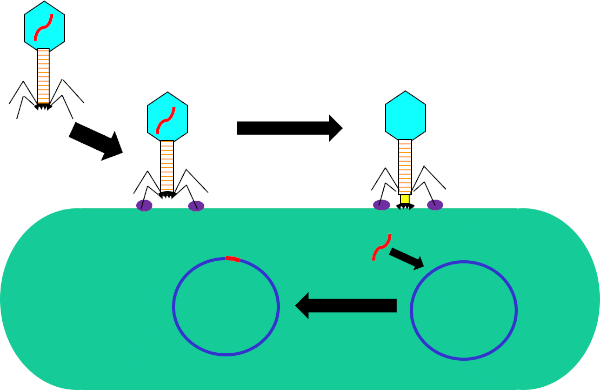
图1:噬菌体感染宿主细胞。通过尾纤维和受体(紫色)之间的相互作用,通过噬菌体吸附到细菌细胞壁。一旦在细胞表面,噬菌体是不可逆转地连接到细菌细胞使用底板(黑色),这是由收缩护套(黄色)移动到细胞壁。噬菌体基因组(红色)然后进入细胞并集成到宿主细胞基因组中。
虽然细菌转导是一个自然发生的过程,但利用现代技术,它纵在实验室环境中将基因转移到细菌中。通过将感兴趣的基因插入基源噬菌体的基因组(如噬菌体)中,能够将这些基因转移到细菌的基因组中,从而在这些细胞中表达这些基因。虽然其他基因转移方法,如转化,使用质粒进行基因转移和表达,但将噬菌体基因组插入受体细菌中不仅有可能赋予这种细菌新的特性,而且还允许自然发生的突变和细胞环境的其他因素,以改变转移基因的功能。
与其他水平基因转移方法(如共偶)相比,转导在供体和受体细胞所需的标准上相当灵活。任何可以适应所使用噬菌体基因组的遗传元素都可以从任何供体细菌菌株转移到任何受体细菌菌株,只要两者都允许噬菌体,需要表达必要的噬菌体受体。细胞表面。一旦这个基因从供体基因组中移出并打包到噬菌体中,就可以转移到受体。转导后,有必要为含有感兴趣的基因的受体细菌选择。这可以通过使用基因标记,如FLAG标记或多血氨酸标记,来标记感兴趣的基因,或基因的内在功能,在编码抗生素耐药性的基因的情况下。此外,PCR还可用于进一步确认成功的转导。通过使用感兴趣的基因中的一个区域的引体并将信号与阳性对照、具有感兴趣基因的细菌和阴性对照的细菌进行比较,细菌经历了与无噬菌体的转导反应相同的步骤。虽然细菌转导是分子生物学的有用工具,但它在细菌的进化中已经并将继续发挥重要作用,特别是在最近抗生素耐药性的上升方面。
在本实验中,细菌转导用于通过P1噬菌体(5)将抗生素氨基青霉素的抗药性基因编码从大肠杆菌的W3110菌株转移到J53菌株。这个实验包括两个主要步骤。首先,从供体菌株制备含有甲异素抗性基因的P1噬菌体。第二,通过P1噬菌体转导将该基因转移到受体菌株(图1)。一旦进行,环青素抗性基因的成功转移可以通过qPCR确定(图2)。如果转导成功,大肠杆菌的J53菌株对氨基青霉素具有抗药性,而该基因可由qPCR检测出这种抗性。如果不成功,将不会检测到阿霉素耐药性基因,而阿霉素仍将作为对抗J53菌株的有效抗生素。
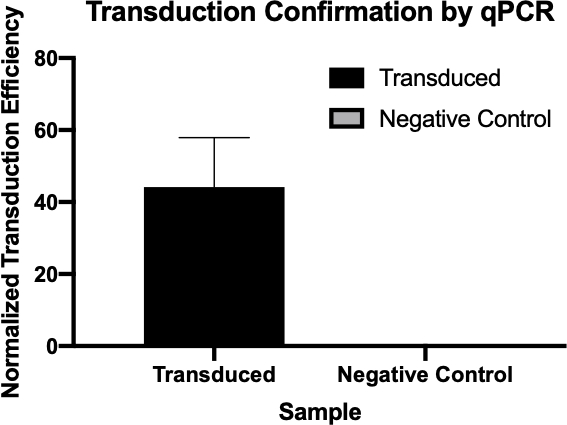
图2:qPCR成功转导的确认。通过比较从转导反应和阴性对照反应中检测到的感兴趣的基因的Cq值,并将这些值与内务管理基因规范化,从而证实细菌转导是成功的。
Procedure
1. 设置
- 在开始任何涉及微生物的工作之前,使用 70% 乙醇对工作空间进行消毒。始终使用必要的个人防护装备(实验室外套和手套)。
- 确保 LB 琼脂板含有 1x 阿霉素,市售 P1 噬菌体莱酸溶液、氯仿、1 M 柠酸钠、甘油以及一盒预消毒塑料移液器尖端和细胞扩散器。
- 通过高压灭菌制备无菌LB,并用它来制造三个1 mL等分的LB盐溶液。
- mM MgCl2 (952.11-2.3803 μg), 5 mM CaCl2 (11.098 毫克), 0.1-0.2% 葡萄糖 (100-200 μg)
- mM MgSO4 (12.0366毫克), 5 mM CaCl2 (11.098毫克)
- mM柠酸钠 (25.806毫克)
- 完成后,用70%乙醇消毒所有表面和手套,然后洗手。
2. 议定书
- 捐赠者噬菌体莱萨特制剂
- 在 LB 中制备 1 mL 的供体 W3110 菌株大肠杆菌,在 37°C 下一夜之间生长 1 倍的阿霉素,在 220 rpm 转速下进行曝气和摇动。
- 稀释此过夜培养物 1:100 在 1 mL 新鲜 LB 补充 10-25 mM MgCl2,5 mM CaCl2和 0.1-0.2% 葡萄糖.
- 在 37°C 下生长此细菌稀释 2 小时,在 220 rpm 下进行曝气和摇动。
- 一旦这些细胞达到早期对数生长阶段(明显生长和轻微浊度),加入40μL的商用P1噬菌体,并在37°C离开,在220rpm下曝气和摇动。
- 在添加噬菌体之前,这些细胞在600nm处测得的光学密度应约为0.4(6)。
- 监测细胞1-3小时,直到培养细胞被感染。
- 流变将导致细胞碎片增加,以及浊度显著下降(即一旦能够看到培养物,细胞将被视为分莱体)。
- 将几滴(50-100 μL)氯仿加入流合物,然后通过涡旋混合。
- 氯仿通过杀死任何剩余的供体细胞来灭菌噬菌体,只留下噬菌体并增加这种莱沙的叶的叶蒂。
- 在 14,000 rpm 转速下离心式莱沙2分钟,以清除碎屑并将上清液转移到新管中。
- 加入几滴氯仿,在4°C下储存不超过一天。
- 转 导
- 制备受体 J53 菌株大肠杆菌的 1 mL 培养,在 LB 中以 37°C 在 LB 中生长过夜,在 220 rpm 下进行曝气和摇动。
- 将100 μL的供体噬菌体解结素(2.1)转移到1.5 mL微管中,在37°C下打开盖子孵育30分钟。
- 这种孵育允许在添加到受体细胞之前蒸发P1解液中剩余的氯仿。
- 在 6,000 rpm 转速下轻轻颗粒受体应变细胞 5 分钟。
- 将这些细胞重新悬浮在含有100 mM MgSO4和5 mM CaCl 2的300μL新鲜LB中。(P1噬菌体要求钙具有传染性)。
- 使用受体细菌细胞和制备的供体噬菌体解结剂设置两种反应:1)转导反应结合100μL受体J53菌株大肠杆菌和100μL供体噬菌体莱沙发生,2)负对照结合100μL受体J53菌株大肠杆菌和100 μL的LB含有100 mM MgSO4和5 mM CaCl2.
- 在 37°C 孵育 30 分钟,在 220 rpm 下摇动。
- 加入 1 mL LB 和 200 μL 1M 柠酸钠 (pH=5.5),在 37°C 下孵育 1 小时,在 220 rpm 转速下摇动。
- 柠酸盐用于降低P1的传染性,通过与钙结合,防止受体细菌的裂化。
- 此溶液的孵育允许表达安培林电阻标记。
- 在 6,000 rpm 转速下离心的颗粒细胞,5 分钟。
- 将细胞颗粒与 100 mM 柠子酸钠 (pH 5.5) 重新悬浮在 100 μL 的 LB 中。涡旋和板整个溶液,用于两个LB琼脂板上的两种反应。
- LB 板应具有 1x 安培用于转导样品,无安培用于负控制。
- 此板上的 P1 噬菌体污染要求在准备冷冻库之前重新进行再条纹。
- 如果不去除噬菌体,从这些菌落中生长的培养物将不会生长,除非存在钙包剂。
- 从两个板中挑选约 3-4 个菌落,并在两个 LB 琼脂板上再次采摘,其分布为 100 μL 的 1 M 柠酸钠 (pH=5.5)。
- LB 板应具有 1x 安培用于转导样品,无安培用于负控制。
- 在37°C过夜孵育板,使无噬菌体菌落生长。
- 从两个板中挑选菌落,并在 37°C 下用 5 mL 的 LB 生长过夜培养物,在 220 rpm 下进行曝气和摇动。
- 使用总培养量的4.5 mL,通过DNA小制备从这些培养物中分离DNA。
- 使用35μL无核酸酶水的脱氧核糖核酸。
- 通过纳米滴测量产生的浓度。纯DNA将产生约1.8的吸收比(A260/280)。
- 使用每种培养物的剩余 0.5 mL,通过 1:1 甘油和细菌培养物的 1:1 混合物制备 1 mL 甘油。
- 将细菌甘油储存在-80°C。
3. 数据分析和结果
- qPCR 转导确认
- 为6种qPCR反应准备两个qPCR主混合物,三个用于环酸素抗基因的qPCR引物,另外三个使用qPCR引物进行内务基因(每个反应14.5μL):12.5μL qPCR缓冲液混合= 1μL正向引物+ 1μL反向引物。
- 在这个实验中,我们使用了SYBR绿色主组合。
- 家政基因引物被设计为在DNA陀螺仪B(7)的细菌基因编码中扩增一段DNA。
- 对于每个qPCR反应,将每种反应的100μgDNA(10.5μL)与14.5μL的qPCR主混合物混合。
- 使用qPCR机和表1中列出的热循环方案,对所有六种反应的环二苯抗性和内务管理基因进行了扩增。
- qPCR生成的Cq值用于计算氨基林抗性基因的正态转导效率(图3),确认氨基林抗性基因转导成功。
- 样品的 Cq 值或周期量化值是检测到信号超过背景阈值的最早的 PCR 周期数。低 Cq 值对应于更多目标序列,反之亦然。
- 样品中基因的标准化转导效率可以通过从这些Cq值中减去目标基因中管理基因的值来计算,生成一个μCq值,可用于计算规范化转导效率由 2(-+Cq).
- 为6种qPCR反应准备两个qPCR主混合物,三个用于环酸素抗基因的qPCR引物,另外三个使用qPCR引物进行内务基因(每个反应14.5μL):12.5μL qPCR缓冲液混合= 1μL正向引物+ 1μL反向引物。
| 温度 | 时间 | |
| 变性 | 94 °C | 2分钟 |
| 40 个周期: | ||
| 变性 | 94 °C | 15 秒 |
| 退火、延伸和荧光读取 | 60 °C 或 5 °C 低于最低底漆 Tm | 1 分钟 |
表1:qPCR热循环协议
细菌可以通过交换遗传物质快速适应快速变化的环境,而它们能够做到这一点的一种方法是通过转导,即通过细菌病毒中介的遗传物质交换。噬菌体通常缩写为噬菌体,是一种病毒,它通过先附着在宿主表面,然后将其DNA注入细菌细胞来感染细菌。然后,它降解宿主细胞自身的DNA并复制其病毒基因组,同时劫持细胞的机械来合成其蛋白质的多个副本。这些噬菌体蛋白然后自我组装和包噬菌体基因组形成多个后代。然而,由于DNA包装机制的保真度低,偶尔,噬菌体将细菌DNA片段包裹到噬菌体囊中。诱导宿主的裂解后,噬菌体后代被释放,一旦这种噬菌体感染另一个宿主细胞,它转移其前宿主的DNA片段。然后,这可以重新组合,并永久地融入到新宿主的染色体中,从而调解两种细菌之间的基因转移。
在实验室中进行噬菌体转导需要含有感兴趣的基因的供体菌株、缺乏该基因的受体菌株、可同时感染该菌株的噬菌体以及选择转导细菌的方法。在大多数情况下,这将是一种选择性的固体生长介质,支持转导细菌的生长,但抑制非转导细菌的生长。首先,含有感兴趣的基因的供体菌株在液体生长培养基中培养。当所有细菌在其生长的日志阶段积极分裂时,培养菌被接种为目标噬菌体。经过三到四个小时的孵育,当几乎所有的细菌都解毒并释放噬菌体颗粒时,供体噬菌体解毒物被接种到刚生长的受体细菌菌株中。经过一个小时的短暂孵育后,培养物现在应包含转导和非转导细菌细胞的混合物,通过将悬浮液的一小部分扩散到适当的选择性固体生长介质上,对转导细胞进行筛选。进一步孵育后,转导细胞应生长和繁殖,以产生可见的菌落。然后,可以使用各种方法选择这些菌落进行进一步分析,以进一步确认成功的转导,如菌落 PCR、DNA 测序或定量 PCR。
在开始手术之前,请穿上任何适当的个人防护装备,包括实验室外套和手套。接下来,用 70% 乙醇对工作空间进行消毒,然后擦拭表面。
在此之后,准备三个一毫升的LB盐溶液等分。现在,通过在含有5毫升LB生长介质和500微克阿霉素的15毫升锥形小瓶中加入100微升大肠杆菌,制备供体菌株培养。然后,在 37 摄氏度的温度下一夜之间生长,在 220 rpm 下进行曝气和摇动。第二天,用70%乙醇擦拭台面,然后从摇动的培养箱中取出培养体。接下来,通过在990微升的新鲜LB中加入10微升的供体菌株,将过夜培养物稀释1至100升,并辅以盐溶液。
允许细菌稀释在37摄氏度下生长两小时,在220rpm下曝气和摇动。一旦细胞达到早期对数阶段,从培养箱中取出培养体,向培养中加入40微升的P1噬菌体,然后再次孵育。继续监测细胞一至三个小时,直到培养体被感染。接下来,在流合物中加入50至100微升氯仿,然后涡旋混合。然后,将液前液离心机以清除碎屑并将上清液转移到新管中。在上清液中加入几滴氯仿,并将其储存在摄氏四度,不超过一天。
要开始转导程序,获得一毫升培养的受体菌株。接下来,将100微升的供体噬菌体解结到1.5毫升微离心管中,在37摄氏度的温度下孵育,盖打开30分钟,使任何剩余的氯仿蒸发。当供体噬菌体孵育时,通过温和的离心颗粒受体应变细胞。丢弃上清液,将细胞颗粒重新悬浮在含有100毫摩尔硫酸镁和5毫摩尔氯化钙的300微升新鲜LB中。
接下来,在微离心管中结合100微升的受体菌株和100微升的供体噬菌体流解酶,建立转导反应。然后,将100微升的受体菌株和100微升的LB与硫酸镁和氯化钙结合,建立负控制。孵育后,在两根管中加入200微升的柠酸柠酸柠二酸柠子钠和一毫升LB,然后轻轻上下移液混合。然后,在管子孵育一小时后,通过离心轻轻颗粒细胞。
离心后,丢弃上清液,用100毫摩尔柠酸钠将颗粒细胞重新悬浮在100微升的LB中。将溶液和移液器整个转导样品移至带 1 倍氨基环比的 LB 琼脂板上。最后,将负控制细胞混合物的整个体积移至无阿霉素的LB琼脂板上。在37摄氏度的温度下孵育板后,使用无菌移液器尖端从转导板中挑选三到四个菌落,并将其条纹到含有1倍氨化素和100微升1摩尔柠子酸钠的新LB琼脂板上。重复这种电镀方法,在另一个LB琼脂板上进行负控制,其中仅含有100微升的一摩尔柠酸钠。然后,在37摄氏度的温度下孵育板,让无噬菌体的菌落生长。
第二天,用70%乙醇擦拭台面,然后再从培养箱中取出盘子。使用无菌移液器尖端,从转导板上挑选三个菌落,并把它们分别添加到包含五毫升LB介质的独立管中。然后,从负控制板中选择三个菌落,并将其添加到另一个含有五毫升LB介质的管中。在 37 摄氏度下生长,在 220 rpm 下曝气和摇动。按照先前演示的对台面进行消毒后,使用 DNA 微型试剂盒根据制造商的说明从每种培养物的 4.5 毫升中分离出 DNA。然后,用35微升无核酸酶水对DNA进行洗脱,并通过实验室分光光度计测量产生的浓度。最后,通过将剩余的0.5毫升两种细菌溶液加入0.5毫升100%甘油来制备甘油。
为了确认转导,首先为24 qPCR反应准备两个qPCR主混合物。对于第一个主混合物,将150微升的qPCR缓冲液混合加入微离心管中,将12微升分别加入用于扩增环素抗性基因的正向和反向引液。接下来,通过将 150 微升 qPCR 主混合物添加到微离心管中,然后加入 12 微升的正向引物和反向底漆,以放大内务基因,制备第二个 qPCR 主混合物。
对于每个qPCR反应,将每个反应的100微克实验DNA与14.5微升的qPCR主混合物混合。现在,准备之前演示的其余反应。将反应转移到预热的热循环器,温度升高至 94 摄氏度,然后启动程序。最后,使用qPCR生成的周期定量值(Cq)计算氨基林抗性基因的正化转导效率。
对每个阴性对照和转导样本的周期定量(Cq)值进行了表格。低 Cq 值(通常低于 29 个周期)(如本示例中的转导样本)表示目标序列的含量很高。
内务管理基因,也在这里表格,被用作负载控制,以标准化每个反应的DNA量,并作为一个积极的控制,以确保qPCR的工作。如果加载相同数量的内务基因,则在每个样本中,它以相对相同的速率被发现。
接下来,要计算每个样本的增量 Cq 值,从相应目标基因的 Cq 值中减去每个样本的内务管理基因的 Cq 值。例如,第一个负控制数的增量 Cq 为 13.54。然后,使用此值使用此处所示的公式计算每个样本的规范化转导效率。最后,计算了每个样本组的平均归一化转导效率。
Subscription Required. Please recommend JoVE to your librarian.
Applications and Summary
通过噬菌体向细菌和细菌转移基因,虽然是一个自然过程,但已证明对多种研究目的非常有用。虽然其他基因转移方法,如转化和共和是可能的,转导唯一使用噬菌体;不仅允许基因集成到宿主基因组中,还允许基因传递到不易受其他方法影响的多种细菌。这个过程虽然在实验室中特别有用,但也被用于最近新兴的基因治疗领域,更具体地说,用于替代基因治疗,这是一种利用细菌提供靶向组织治疗的治疗策略,其中许多不易受其他分娩方法的影响,并且具有很大临床相关性(8,9)。
Subscription Required. Please recommend JoVE to your librarian.
References
- Lederberg J, Lederberg E.M., Zinder, N.D., et al. Recombination analysis of bacterial heredity. Cold Spring Harbor symposia Quantitative Biol. 1951;16:413-43.
- Duckworth DH. "Who Discovered Bacteriophage?". Bacteriology Reviews. 1976;40:793-802.
- Yap ML, Rossman, M.G. Structure and Function of Bacteriophage T4. Future Microbiol. 2014;9:1319-27.
- Sulakvelidze A, Alavidze, Z., Morris, J. G. Bacteriophage Therapy Antimicrobial Agents and Chemotherapy 2001;45(3):649-59.
- Moore S. Sauer:P1vir phage transduction 2010 [Available from: https://openwetware.org/wiki/Sauer:P1vir_phage_transduction].
- Kobayashi A, et al. Growth Phase-Dependent Expression of Drug Exporters in
- Escherichia coli and Its Contribution to Drug Tolerance. Journal of Bacteriology. 2006;188(16):5693-703.
- Rocha D, Santos, CS, Pacheco LG. Bacterial reference genes for gene expression studies by RT-qPCR: survey and analysis. Antonie Van Leeuwenhoek. 2015;108:685-93.
- Pálffy R. et al. Bacteria in gene therapy: bactofection versus alternative gene therapy. Gene Ther. 2006 13:101-5.
- O'Neill JM, et al. Intestinal delivery of non-viral gene therapeutics: physiological barriers and preclinical models. Drug Discovery Today. 2011;16:203-2018.




