2.3:
Elementos: Símbolos Químicos e Isótopos
2.3:
Elementos: Símbolos Químicos e Isótopos
Um símbolo químico é uma abreviatura utilizada para indicar um elemento ou um átomo de um elemento. Por exemplo, o símbolo do mercúrio é Hg. O mesmo símbolo é usado para indicar um átomo de mercúrio (domínio microscópico) ou para rotular um recipiente de muitos átomos do elemento mercúrio (domínio macroscópico).
Alguns símbolos são derivados do nome comum Inglês do elemento; outros são abreviações do nome em outra língua — Latim, Grego ou Alemão. Por exemplo, o símbolo para o alumínio (nome comum) é Al, enquanto que para o ferro é Fe, que deriva do seu nome em Latim “Ferrum”. A maioria dos símbolos tem uma ou duas letras, mas símbolos de três letras foram usados para descrever alguns elementos que têm números atómicos maiores que 112. Para evitar confusões com outras notações, apenas a primeira letra de um símbolo é maiúscula. Por exemplo, Co é o símbolo do elemento cobalto, mas CO é a notação para o composto monóxido de carbono, que contém átomos dos elementos carbono (C) e oxigénio (O).
Tradicionalmente, quem descobre um novo elemento dá nome ao elemento. No entanto, até que o nome seja reconhecido pela União Internacional de Química Pura e Aplicada (IUPAC), o nome recomendado para o novo elemento baseia-se na(s) palavra(s) em Latim para o seu número atómico. Por exemplo, o elemento 106 foi chamado de unnilhexium (Unh), o elemento 107 foi chamado de unnilseptium (Uns), e o elemento 108 foi chamado de unniloctium (Uno) por vários anos. Estes elementos são agora nomeados a partir de cientistas (ou ocasionalmente locais); por exemplo, o elemento 106 é agora conhecido como seaborgium (SG) em honra de Glenn Seaborg, um vencedor do Prémio Nobel que foi activo na descoberta de vários elementos pesados.
Cada quadrado da tabela periódica contém, no mínimo, um número atómico — que é também o número de protões — e um símbolo químico.
No caso de um isótopo, o número de massa ou a soma dos protões e neutrões é indicado juntamente com o símbolo e o número atómico. O número de massa define o isótopo específico de um elemento. Por exemplo, estes são os dois isótopos do azoto:
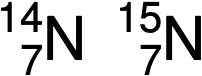
O símbolo de um isótopo específico de qualquer elemento é escrito colocando o número de massa como um sobrescrito à esquerda do símbolo do elemento. Como o número atómico define a identidade do elemento, assim como o seu símbolo, ele é muitas vezes omitido. Por exemplo, o magnésio existe como uma mistura de três isótopos, cada um com um número atómico de 12 e com números de massa de 24, 25 e 26, respectivamente. Estes isótopos podem ser identificados como 24Mg, 25Mg, e 26Mg. Estes símbolos isotópicos são lidos como “elemento, número de massa” e podem ser simbolizados de forma consistente com esta leitura. Por exemplo, 24Mg é lido como “magnésio 24” e pode ser escrito como “magnésio-24” ou “Mg-24”. 25Mg é lido como “magnésio 25”, e pode ser escrito como “magnésio-25” ou “Mg-25”. Todos os átomos de magnésio têm 12 protões no seu núcleo. Diferem apenas porque um átomo de 24Mg tem 12 neutrões no seu núcleo, um átomo de 25Mg tem 13 neutrões, e um de 26Mg tem 14 neutrões.
Note-se que, para além dos nomes e símbolos padrão, os isótopos do hidrogénio são frequentemente referidos utilizando nomes comuns e símbolos que os acompanham. O hidrogénio-2, simbolizado como 2H, também é chamado de deutério e às vezes simbolizado como D. hidrogénio-3, simbolizado como 3H, também é chamado de trítio e às vezes simbolizado como T.
Texto adaptado de Openstax Chemistry 2e, Section 2.3: Atomic Structure and Symbolism.
Suggested Reading
- Pothoof, Justin, Grace Nguyen, Dawn Archey, E. Prasad Venugopal, and Mark A. Benvenuto. "Element 118: Teaching A New Element to New Students." In Elements Old and New: Discoveries, Developments, Challenges, and Environmental Implications, pp. 195-201. American Chemical Society, 2017.
- Krebs, Robert E. The history and use of our earth's chemical elements: a reference guide. Greenwood Publishing Group, 2006.
- Clayton, Donald. Handbook of isotopes in the cosmos: Hydrogen to gallium. Vol. 1. Cambridge University Press, 2003.
