3.8:
화합물의 화학식 질량과 몰 개념
3.8:
화합물의 화학식 질량과 몰 개념
공유 화합물의 포뮬러 질량
화학 포뮬러는 물질의 원소 구성을 나타냅니다. 공유 화합물의 경우, 수식은 물질의 단일 분자를 구성하는 원자의 숫자와 유형을 나타냅니다. 따라서, 상기 포뮬러 질량은 분자 질량이라고 정확하게 지칭될 수 있다. 동연 화합물인 클로로폼(CHCl3)의분자 포뮬러는 단일 분자에 탄소 원자 1개, 수소 원자 1개, 염소 원자 3개가 포함되어 있음을 나타낸다. 클로로폼 분자의 평균 분자 질량은 이러한 원자의 평균 원자 질량의 합계와 동일합니다.
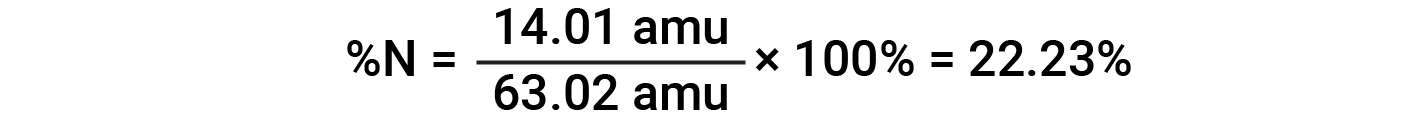
이온 화합물의 포뮬러 질량
이온 화합물은 전기적으로 중성 벌크 물질을 산출하기 위해 비율로 결합된 이산 양이온 및 음이온으로 구성됩니다. 이온 화합물에 대한 수식 질량은 공유 화합물에 대한 공식 질량과 동일한 방식으로 계산됩니다: 화합물의 수식에 있는 모든 원자의 평균 원자 질량을 합산하여. 그러나, 이온 화합물에 대한 포뮬러는 이산 분자의 조성을 나타내지 않으므로 정확하게 ‘분자 질량’이라고 불리지 않을 수 있다.
예를 들어, 일반적인 테이블 염자 또는 염화나트륨(NaCl)은 나트륨 양이온(Na+)과염화물 이온(Cl−)으로 구성된 이온 화합물을 1:1 비율로 결합한다. 이 화합물에 대한 수식 질량은 구성 요소의 평균 원자 질량을 추가하여 계산됩니다.
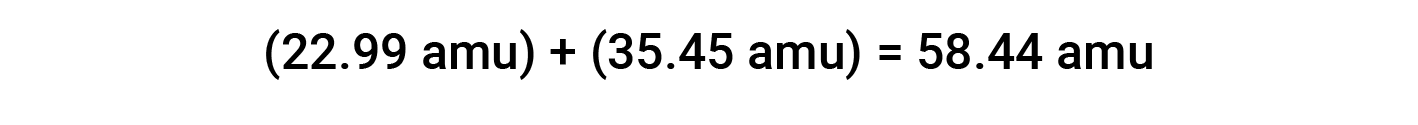
이온 화합물의 공식 질량을 계산할 때, 중성 나트륨과 염소 원자의 평균 질량은 나트륨 양이온및 염화물 음이온을 위한 질량보다는 이용되었습니다. 나트륨 양이온은 나트륨 원자보다 약간 작은 질량을 가지고 있지만 (전자가 누락되었기 때문에), 이 차이는 염화물 음이온이 염소 원자 (여분의 전자로 인해)보다 약간 더 크다는 사실에 의해 상쇄될 것입니다. 더욱이, 전자의 질량은 전형적인 원자의 질량에 대하여 무시할 정도로 작습니다.
질량 백분율 컴포지션
화합물의 원소 메이크업은 화학적 정체성을 정의하며 화학 포뮬러는 이 원소 메이크업을 나타내는 가장 간결한 방법입니다. 화합물내의 각 요소의 질량별 백분율을 해당 특정 요소의 질량 백분율이라고 합니다. 백분율 조성물은 각 요소의 질량을 화합물의 전체 질량으로 나눈 다음 백분율로 변환하여 계산할 수 있다.
백분율 조성은 알려진 수식의 다른 화합물에서 주어진 요소의 상대적 풍부를 평가하는 데 유용합니다. 문제의 화합물의 분자 또는 경험적 공식이 알려진 한, 백분율 조성물은 화합물의 원소의 원자 또는 어금니 덩어리로부터 유래될 수 있다.
예를 들어, 질산(HNO3)의1분자는 14.01 amu, 1.008 amu의 1개의 수소 원자, 3개의 산소 원자 계량(3× 16.00 amu) = 48.00 amu를 함유하고 있다. 따라서 질산의 공식 질량은 (14.01 amu + 1.008 amu + 48.00 amu) = 63.02 amu이며 퍼센트 조성물은 다음과 입니다.
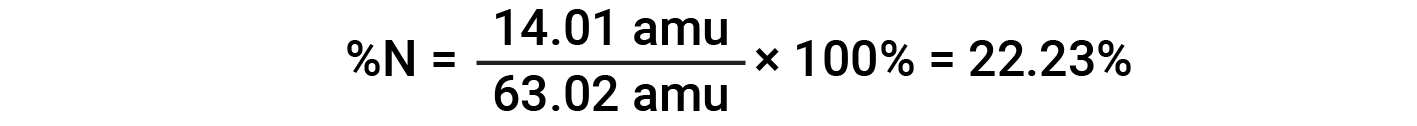
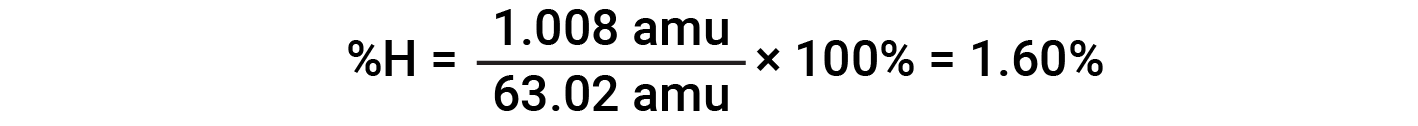
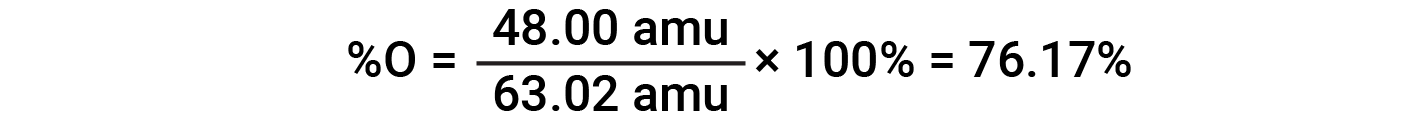
이 텍스트는 Openstax, 화학 2e, 섹션 3.1: 포뮬러 질량 및 두더지 개념 및 개방세, 화학 2e, 섹션 3.2: 경험 및 분자 수식 결정에서 채택됩니다.
