4.2:
限量反应物
A subscription to JoVE is required to view this content. Sign in or start your free trial.
JoVE Core
Chemistry
Limiting Reactant
在一个化学反应中,反应物 相互作用以形成产物。完全消耗的反应物 为限量反应物,而反应物存在的量 大于与限量反应物 完全反应所需的量,即为过量反应物。配方类比有助于理解这些概念。在这里,一杯面粉、两个鸡蛋和三汤匙糖 可以做成五个华夫饼。那么如果有 3 杯面粉、4 个鸡蛋 和 8 汤匙的糖,可以做成多少个华夫饼?这里的面粉足够做 15 个华夫饼,糖足够 做 13 又1/3 个华夫饼。然而,鸡蛋只够做 10 个华夫饼。在这里,鸡蛋是限量反应物,因为它制造的华夫饼的量是最少的,而面粉和糖则是过量的。现在,考虑一下甲烷和氧气 之间的燃烧反应,产生的是二氧化碳 和水。回想一下,平衡方程的系数 代表反应物和产物的 化学计量量。因此,甲烷与二氧化碳的 化学计量摩尔比为 1:1,而氧气与二氧化碳的化学计量摩尔比为 2:1。假设有 80 克的甲烷 和 128 克的氧气。哪种是限量反应物,会形成多少二氧化碳?首先,反应物的质量 必须用它们的摩尔质量转换成摩尔。按化学计量,5 摩尔的甲烷 产生 5 摩尔的二氧化碳,而 4 摩尔的氧气只产生 2 摩尔的二氧化碳。由于氧气产生的二氧化碳量最少,它是限量反应物,而甲烷 是过量反应物。知道了限量反应物,产物的摩尔数 可以转化为克。因此,可以产生 88 克的二氧化碳。但是有多少甲烷没有反应呢?甲烷与氧气的摩尔比 表明,4 摩尔的氧气 会与 2 摩尔的甲烷完全反应。所以,3 摩尔未反应的甲烷是过量的。
4.2:
限量反应物
以平衡化学方程式表示的反应物和产物的相对量通常称为<化学计量比。然而,实际上,反应物并不总是以平衡方程所指示的化学计量的量存在。
在化学反应中,首先消耗掉并限制形成的产物量的反应物是限制性反应物,而另一种物质则成为过量反应物。通常使用过量的一种或多种反应物来确保另一种反应物完全转化为产物。
考虑由以下方程式表示的水形成反应:
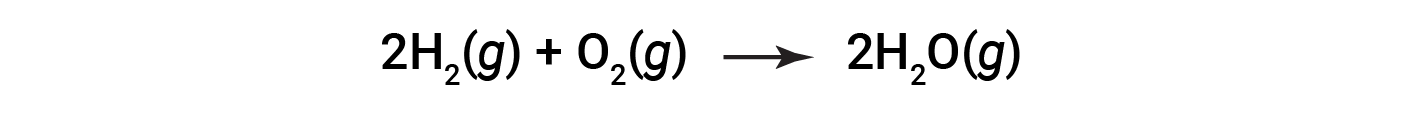
平衡方程表明氢和氧以2:1的化学计量比反应。如果这些反应物以任何其他量提供,则其中一种反应物几乎总是被完全消耗掉,从而限制了可能产生的产物的量。该物质是限制性反应物,另一种物质是过量反应物。要确定给定情况下的限制反应物和过量反应物,需要计算所提供的每种反应物的摩尔量,并将其与平衡化学方程式中表示的化学计量量进行比较。
化学计量表明,两摩尔的氢和一摩尔的氧反应生成两摩尔的水;也就是说,氢和氧以2:1的比例结合。想象一下,如果存在5摩尔的氢和2摩尔的氧。现在反应物的比例为5:2(或2.5:1),大于化学计量比2:1。因此,氢气过量存在,而氧气是限制性反应物。所有提供的氧气(2摩尔)的反应将消耗5摩尔提供的氢中的4摩尔,剩下1摩尔未反应的氢。计算提供的每种反应物的摩尔量,并将其与平衡化学方程式中表示的化学计量量进行比较,是确定极限反应物和过量反应物的一种方法。 一种替代方法涉及根据反应的化学计量计算由每种反应物以摩尔计形成的产物的量,然后比较该量。产生较少量产物摩尔的反应物是极限反应物。例如,五摩尔氢的完全反应将产生:
类似地,两摩尔氧气的完全反应将产生:


因此,(5摩尔H 2 &minus; 4摩尔H 2 = 1摩尔H 2 ),一摩尔未反应的氢此反应完成后,仍保留。
