4.2:
Reagente Limitante
4.2:
Reagente Limitante
As quantidades relativas de reagentes e produtos representados em uma equação química equilibrada são muitas vezes referidas como quantidades estequiométricas. No entanto, na realidade, os reagentes nem sempre estão presentes nas quantidades estequiométricas indicadas pela equação equilibrada.
Em uma reação química, o reagente que é consumido primeiro, e limita a quantidade de produto formado, é o reagente limitante, enquanto que a outra substância se torna no reagente em excesso. Um excesso de um ou mais reagentes é frequentemente utilizado para garantir a conversão completa do outro reagente no produto.
Considere a reação para a formação de água representada pela equação:
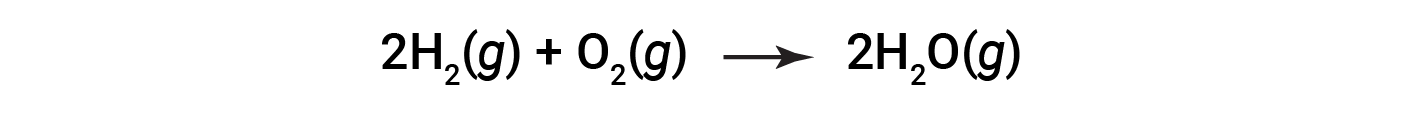
A equação equilibrada mostra a reação do hidrogénio e do oxigénio em uma relação estequiométrica de 2:1. Se esses reagentes forem fornecidos em qualquer outra quantidade, um dos reagentes será quase sempre totalmente consumido, limitando assim a quantidade de produto que pode ser formada. Esta substância é o reagente limitante e a outra substância é o reagente em excesso. A identificação dos reagentes limitantes e em excesso para uma determinada situação requer a determinação das quantidades molares de cada reagente fornecido e a comparação das mesmas com as quantidades estequiométricas representadas na equação química equilibrada.
A estequiometria indica que dois moles de hidrogénio e um mole de oxigénio reagem para produzir dois moles de água, ou seja, hidrogénio e oxigénio combinam-se em uma razão de 2:1. Imagine se estiverem presentes 5 moles de hidrogénio e 2 moles de oxigénio. A razão entre os reagentes é agora de 5:2 (ou 2,5:1), que é maior do que a relação estequiométrica de 2:1. O hidrogénio, portanto, está presente em excesso e o oxigénio é o reagente limitante. A reação de todo o oxigénio fornecido (2 mol) irá consumir 4 mol dos 5 mol de hidrogénio fornecidos, deixando 1 mol de hidrogénio sem reagir. Computar as quantidades molares de cada reagente fornecido e compará-las com as quantidades estequiométricas representadas na equação química equilibrada é uma forma de identificar o reagente limitante e o em excesso.
Uma abordagem alternativa envolve o cálculo da quantidade de produto formado em moles de cada reagente, de acordo com a estequiometria da reação e, em seguida, comparar as quantidades. O reagente que produz uma quantidade menor de moles de produto é o reagente limitante. Por exemplo, a reação completa de cinco moles de hidrogénio produziria:

Da mesma forma, a reação completa de dois moles de oxigénio produziria:

O oxigénio produz menos moles de água e, por conseguinte, o oxigénio é o reagente limitante. O oxigénio será completamente consumido depois de terem sido produzidos 4 moles de H2O. A estequiometria entre hidrogénio e oxigénio é de 2:1, são necessários quatro moles de hidrogénio para reagir com dois moles de oxigénio.

Assim, (5 mol H2 − 4 mol H2 = 1 mol H2), um mole de hidrogénio que não reage irá permanecer assim que esta reação estiver concluída.
Este texto é adaptado de OpenStax, Chemistry 2e, Section 4.4: Reaction Yield.
