4.10:
산화환원반응
4.10:
산화환원반응
산화-감소 반응
지구 대기에는 약 20%의 분자 산소, O2,호기성 유기체의 대사와 세계를 형성하는 많은 환경 프로세스에서 필수적인 역할을 하는 화학적 반응성 가스가 포함되어 있습니다. 산화라는 용어는 원래O2와관련된 화학 반응을 설명하는 데 사용되었지만 그 의미는 산화-감소(redox) 반응으로 알려진 광범위하고 중요한 반응 클래스를 지칭하기 위해 진화했습니다.
일부 레독스 반응은 염화나트륨을 산출하기 위해 나트륨과 염소 사이의 반응과 같은 이온 제품을 산출하기 위해 반응종 사이의 전자의 전달을 포함합니다.

각 개별 반응제, 즉 반 반응이라고 하는 방정식의 형태로 각 반응제의 운명을 나타내는 프로세스를 보는 것이 도움이 됩니다.

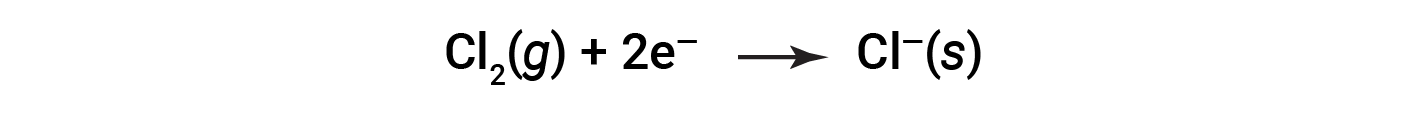
이러한 방정식은 나 원자가 전자를 잃는 것을 보여 주며, Cl 원자(Cl2 분자에서)는 전자를 얻으며,“s”하위 스크립트는 고체 이온 화합물의 형태로 존재한다는 것을 의미하는 결과 이온에 대한 하위 스크립트이다. 이러한 종류의 레독스 반응의 경우 전자의 손실 과 이득은 발생하는 상호 보완적 인 프로세스를 정의합니다.
산화 = 전자 손실
감소 = 전자의 이득
이 반응에서 나트륨은 산화되고 염소는 감소를 겪습니다. 더 적극적인 관점에서 볼 때, 나트륨은 염소에 전자를 제공하기 때문에 환원제 (환원제)로 작용합니다. 마찬가지로 염소는 산화제(산화제)로서 기능하며, 나트륨에서 전자를 효과적으로 제거합니다.
산화된 종 = 감소 에이전트 = 종
산화제 = 감소되는 종
일반적으로 산화제는 환원제로부터 전자를 얻고 그 자체가 감소합니다. 산화 제의 충전은 더 부정적인된다. 마찬가지로, 환원제는 산화제에 전자를 잃고 그 자체가 산화됩니다. 환원제의 충전은 더욱 양해해집니다.
그러나 일부 레독스 공정은 전자의 전달을 포함하지 않습니다. 예를 들어, NaCl을 산출하는 것과 유사한 반응을 고려하십시오.
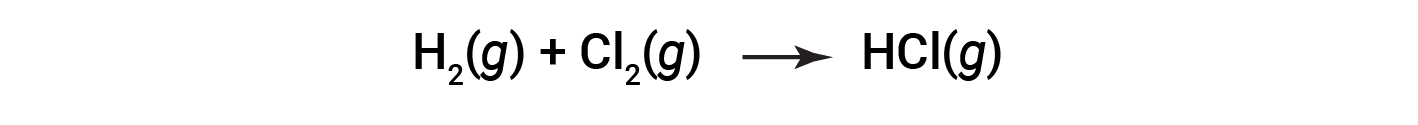
이 반응의 생성물은 공유 화합물이므로 명시적 의미에서 전자의 전달은 관련이 없습니다. 이 반응의 유사성을 이전 반응과 명확히 하고 redox 반응의 명확한 정의를 허용하기 위해 산화 번호라는 속성이 정의되었습니다.
