5.8:
Velocità molecolari ed energia cinetica
5.8:
Velocità molecolari ed energia cinetica
La teoria molecolare cinetica spiega qualitativamente i comportamenti descritti dalle varie leggi sul gas. I postulati di questa teoria possono essere applicati in modo più quantitativo per ricavare queste singole leggi.
Collettivamente, le molecole in un campione di gas hanno energia cinetica media e velocità media; ma individualmente, si muovono a velocità diverse. Le molecole subiscono spesso collisioni elastiche in cui il momento è conservato. Poiché le molecole in collisione vengono deviate a velocità diverse, le singole molecole hanno velocità molto variabili. Tuttavia, a causa del gran numero di molecole e collisioni coinvolte, la distribuzione della velocità molecolare e la velocità media sono costanti. Questa distribuzione della velocità molecolare è nota come distribuzione di Maxwell-Boltzmann, e rappresenta il numero relativo di molecole in un campione sfuso di gas che possiede una data velocità.
L’energia cinetica (KE) di una particella di massa (m) e velocità (u) è data da:
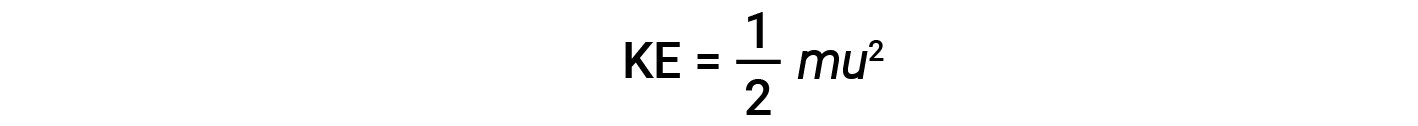
Esprimere massa in chilogrammi e velocità in metri al secondo produrrà valori energetici in unità di joule (J = kg·m2/s2). Per affrontare un gran numero di molecole di gas, usiamo medie sia per la velocità che per l’energia cinetica. Nel KMT, la velocità quadratica media della radice di una particella, urms, è definita come la radice quadrata della media dei quadrati delle velocità con n = il numero di particelle:
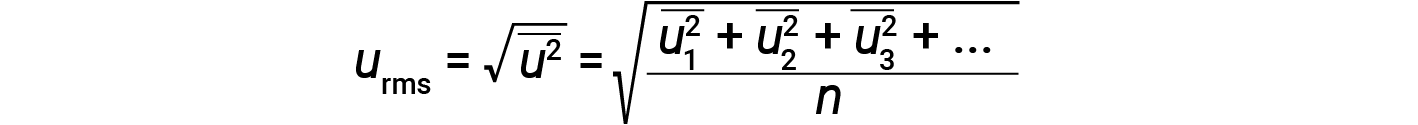
L’energia cinetica media per una talpa di particelle, KEavg, è quindi uguale a:
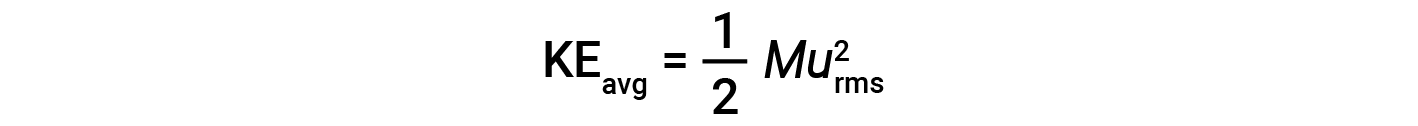
dove M è la massa molare espressa in unità di kg/mol. La media KEdi una talpa di molecole di gas è anche direttamente proporzionale alla temperatura del gas e può essere descritta dall’equazione:
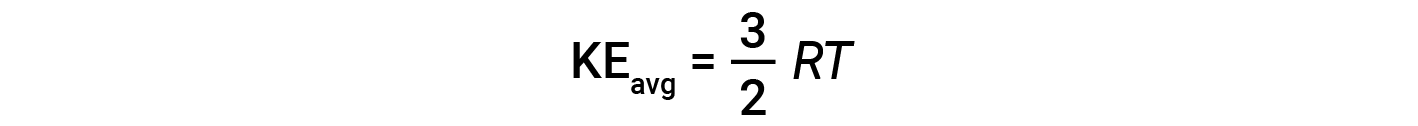
dove R è la costante di gas e T è la temperatura di kelvin. Se utilizzata in questa equazione, la forma appropriata della costante di gas è di 8,314 J/mol-K (8,314 kg·m2/s2·mol· K). Queste due equazioni separate per KEavg possono essere combinate e riorganizzate per produrre una relazione tra velocità molecolare e temperatura:
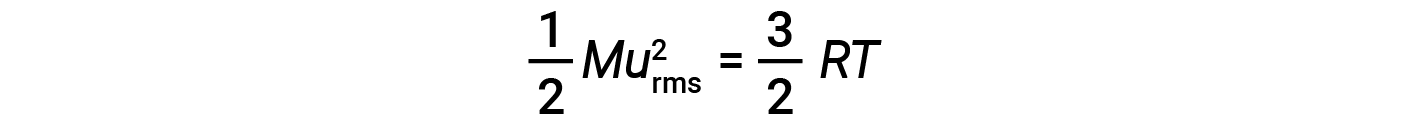
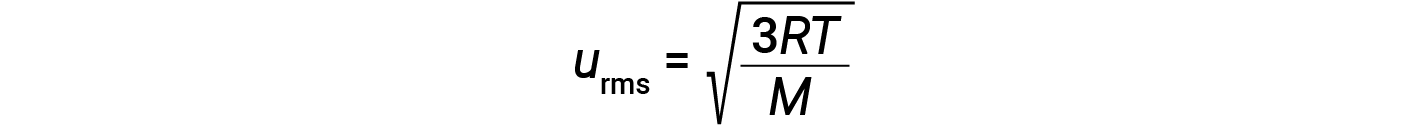
Se la temperatura di un gas aumenta, la sua MEDIA KEaumenta, più molecole hanno velocità più elevate e meno molecole hanno velocità più basse, e la distribuzione si sposta verso velocità più elevate in generale, cioè a destra. Se la temperatura diminuisce, keavg diminuisce, più molecole hanno velocità più basse e meno molecole hanno velocità più elevate, e la distribuzione si sposta verso velocità più basse in generale, cioè a sinistra.
Ad una data temperatura, tutti i gas hanno lo stesso KEavg per le loro molecole. La velocità molecolare di un gas è direttamente correlata alla massa molecolare. I gas composti da molecole più leggere hanno particelle ad alta velocità e un urms piùelevato,con una distribuzione della velocità che raggiunge picchi a velocità relativamente più elevate. I gas costituiti da molecole più pesanti hanno più particelle a bassa velocità, un urmsinferiore e una distribuzione della velocità che raggiunge picchi a velocità relativamente più basse.
Questo testo è adattato da Openstax, Chemistry 2e, Section 9.5: Kinetic-Molecular Theory.
