6.8:
Calorimetria a pressione costante
6.8:
Calorimetria a pressione costante
La calorimetria è una tecnica utilizzata per misurare la quantità di calore coinvolto in un processo chimico o fisico o per misurare il calore trasferito da o verso una sostanza. Il calore viene scambiato con un dispositivo calibrato e isolato chiamato calorimetro. Gli esperimenti di calorimetria si basano sul presupposto che non vi sia scambio di calore tra il calorimetro isolato e l’ambiente esterno. I calorimetri ben isolati impediscono il trasferimento di calore tra il calorimetro e il suo ambiente esterno, che limita efficacemente l'”ambiente circostante” ai componenti non di sistema all’interno del calorimetro (e del calorimetro stesso). Ciò consente di determinare con precisione il calore coinvolto nei processi chimici, come il contenuto energetico degli alimenti.
La variazione di temperatura misurata dal calorimetro viene utilizzata per ricavare la quantità di calore trasferita dal processo in esame. In un calorimetro, un sistema è definito come la sostanza o le sostanze che subiscono il cambiamento chimico o fisico, o in altre parole, la reazione, e l’ambiente circostante sono tutte le altre questioni, compresa la soluzione e qualsiasi altro elemento nel calorimetro che forniscono calore al sistema o assorbono calore dal sistema.
Prima di discutere la calorimetria delle reazioni chimiche, considera un esempio più semplice che illustra l’idea centrale alla base della calorimetria. Supponiamo che un pezzo di metallo caldo ad alta temperatura sia posto in una sostanza a bassa temperatura, come l’acqua fredda. Il calore fluirà dalla metallo caldo all’acqua. La temperatura del metallo diminuirà e la temperatura dell’acqua aumenterà fino a quando le due sostanze non avranno la stessa temperatura, cioè quando raggiungono l’equilibrio termico. Se ciò si verifica in un calorimetro, tutto il calore viene trasferito tra le due sostanze, senza calore guadagnato o perso dal suo ambiente esterno. In queste circostanze ideali, il cambiamento di calore netto è pari a zero:
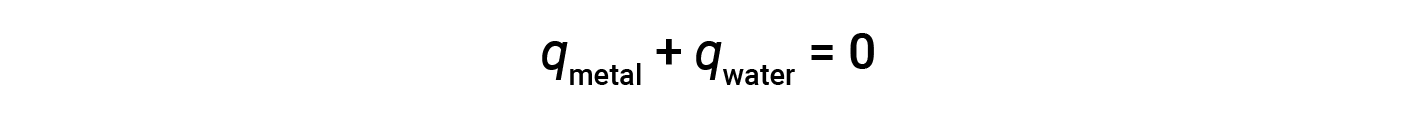
Questa relazione può essere riorganizzata per mostrare che il calore guadagnato dal metallo è uguale al calore perso dalla sostanza l’acqua:
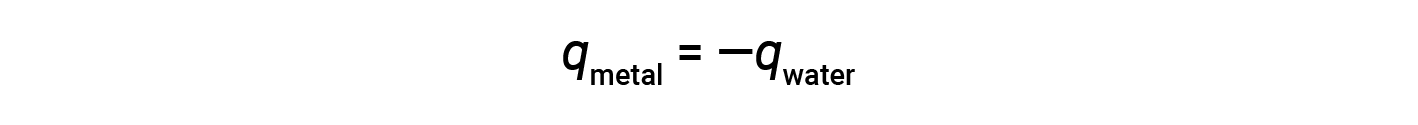
L’entità del calore (cambiamento) è, quindi, la stessa per entrambe le sostanze. Il segno negativo mostra semplicemente che qmetallo e q acqua sono opposti in direzione del flusso di calore (guadagno o perdita), ma non indica il segno aritmetico di entrambi i valori q (cioè determinato dal fatto che la materia in questione guadagni o perda calore, per definizione). Nella situazione specifica descritta, q metalloè un valore negativo e q acqua è un valore positivo poiché il calore viene trasferito dal metallo all’acqua.
Quando si utilizza la calorimetria per determinare il calore coinvolto in una reazione chimica, si applicano gli stessi principi. La quantità di calore assorbita dal calorimetro è spesso abbastanza piccola da poter essere più spesso trascurata, e il calorimetro riduce al minimo lo scambio di energia con l’ambiente esterno. Quando una reazione esotermica si verifica in soluzione in un calorimetro, il calore prodotto dalla reazione viene assorbito dalla soluzione, il che aumenta la sua temperatura. Quando si verifica una reazione endotermica, il calore richiesto viene assorbito dall’energia termica della soluzione, che diminuisce la sua temperatura. La variazione di temperatura (ΔT),insieme al calore specifico (csoln) e alla massa della soluzione (msoln), può quindi essere utilizzata per calcolare la quantità di calore (qsoln) coinvolta in entrambi i casi.
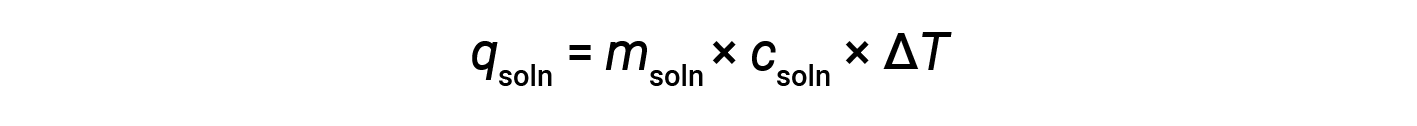
Un semplice calorimetro – chiamato calorimetro della tazza di caffè – è costruito da due tazze di polistirolo nidificate chiuse con un coperchio aderente. I calorimetri a tazza di caffè vengono utilizzati per misurare il calore delle reazioni che si svolgono in soluzioni (per lo più soluzioni acquose) e non comportano variazioni di volume o molto poco. Poiché l’energia non viene né creata né distrutta durante una reazione chimica, il calore prodotto o consumato nella reazione (il “sistema”), qrxn, più il calore assorbito o perso dalla soluzione (l'”ambiente circostante”), qsoln, deve sommarsi a zero:
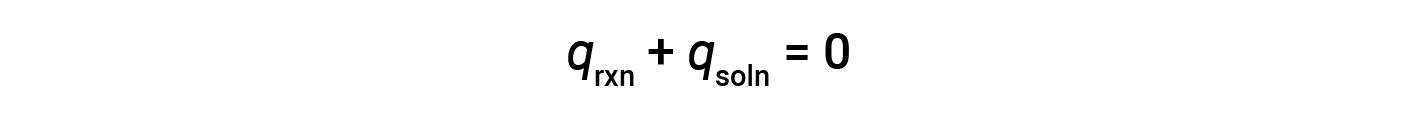
Ciò significa che la quantità di calore prodotta o consumata nella reazione è uguale alla quantità di calore assorbito o perso dalla soluzione:
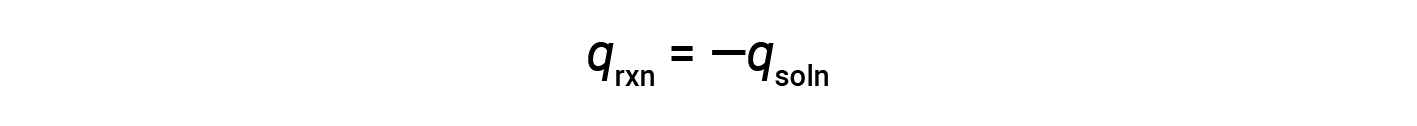
Il calorimetro della tazza di caffè è un calorimetro a pressione costante e il calore misurato della reazione è equivalente al cambiamento di entalpia.
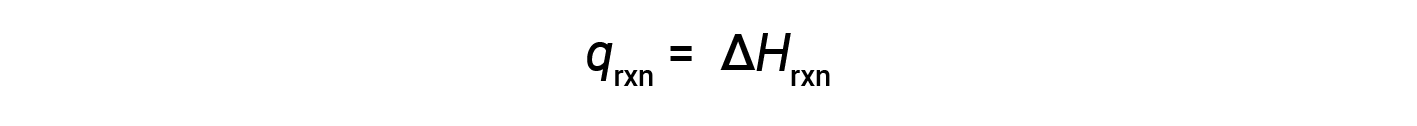
Questo testo è adattato da Openstax, Chimica 2e, Sezione 5.2: Calorimetria.
Suggested Reading
- Banna, M. Salim. "A heater for constant-pressure calorimetry." Journal of Chemical Education 63, no. 11 (1986): 997.
- Ruekberg, Ben. "An economical, safe, and sturdy student calorimeter." Journal of Chemical Education 71, no. 4 (1994): 333.
- Stankus, John J., and Jennifer D. Caraway. "Replacement of coffee cup calorimeters with fabricated beaker calorimeters." Journal of Chemical Education 88, no. 12 (2011): 1730-1731.
