6.8: Calorimetria de Pressão Constante
A calorimetria é uma técnica utilizada para medir a quantidade de calor envolvida em um processo químico ou físico ou para medir o calor transferido de ou para uma substância. O calor é trocado através de um aparelho calibrado e isolado chamado calorímetro. As experiências de calorimetria baseiam-se no pressuposto de que não existe troca térmica entre o calorímetro isolado e o ambiente externo. Os calorímetros bem isolados evitam a transferência de calor entre o calorímetro e o seu ambiente externo, o que limita efetivamente as “imediações” aos componentes não-sistema dentro do calorímetro (e o próprio calorímetro). Isto permite a determinação precisa do calor envolvido em processos químicos, como o teor energético dos alimentos.
A alteração da temperatura medida pelo calorímetro é utilizada para derivar a quantidade de calor transferida pelo processo em estudo. Em um calorímetro, um sistema é definido como a substância ou substâncias sujeitas a alterações químicas ou físicas ou, por outras palavras, a reação, e as imediações são toda a outra matéria, incluindo a solução e quaisquer outros componentes no calorímetro que fornecem calor ao sistema ou absorvem calor do sistema.
Antes de discutir a calorimetria das reações químicas, considere um exemplo mais simples que ilustra a idéia central por trás da calorimetria. Suponha que um pedaço de metal quente a uma temperatura elevada é colocado em uma substância a baixa temperatura, como água fria. O calor fluirá do metal quente para a água. A temperatura do metal diminuirá e a temperatura da água aumentará até que as duas substâncias tenham a mesma temperatura, ou seja, quando atingirem o equilíbrio térmico. Se isto ocorrer em um calorímetro, todo o calor é transferido entre as duas substâncias, sem que o calor seja obtido ou perdido pelo seu ambiente externo. Nestas circunstâncias ideais, a alteração líquida de calor é zero:
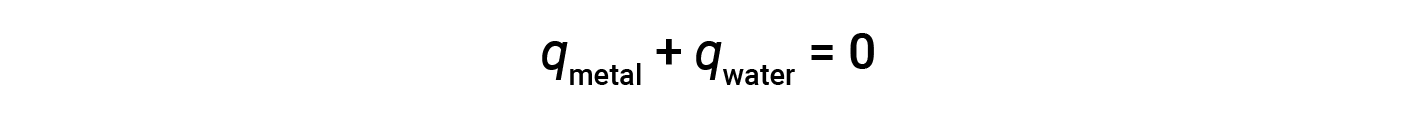
Esta relação pode ser reorganizada para mostrar que o calor ganho pelo metal é igual ao calor perdido pela substância água:
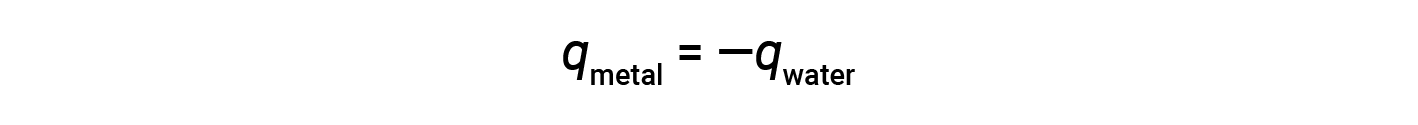
A magnitude do calor (alteração) é, portanto, a mesma para ambas as substâncias. O sinal negativo mostra apenas que qmetal e qágua são opostos na direção do fluxo de calor (ganho ou perda), mas não indica o sinal aritmético de nenhum dos valores de q (que é determinado se a matéria em questão ganha ou perde calor, por definição). Na situação específica descrita, qmetal é um valor negativo e qágua é um valor positivo, uma vez que o calor é transferido do metal para a água.
Ao utilizar a calorimetria para determinar o calor envolvido em uma reação química, aplicam-se os mesmos princípios. A quantidade de calor absorvida pelo calorímetro é muitas vezes suficientemente pequena para que possa ser geralmente negligenciada, e o calorímetro minimiza a troca de energia com o ambiente externo. Quando ocorre uma reação exotérmica em solução em um calorímetro, o calor produzido pela reação é absorvido pela solução, o que aumenta a sua temperatura. Quando ocorre uma reação endotérmica, o calor necessário é absorvido da energia térmica da solução, o que diminui a sua temperatura. A mudança de temperatura (ΔT), juntamente com o calor específico (em>csoln) e a massa (msoln) da solução, pode então ser utilizada para calcular a quantidade de calor (qsoln) envolvida em qualquer dos casos.
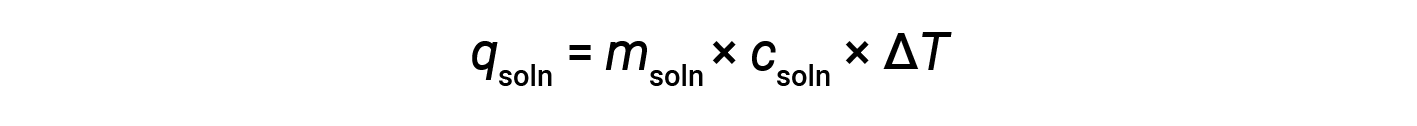
Um calorímetro simples — chamado de calorímetro de xícara de café — é construído a partir de duas xícaras de poliestireno aninhadas fechadas com uma tampa solta. Os calorímetros de xícara de café são utilizados para medir o calor das reações que ocorrem em soluções (na sua maioria soluções aquosas) e não implicam uma alteração de volume ou têm uma alteração de volume muito reduzida. Uma vez que a energia não é criada nem destruída durante uma reação química, o calor produzido ou consumido na reação (o “sistema”), qrxn, mais o calor absorvido ou perdido pela solução (as “imediações”), qsoln, deve ser zero:
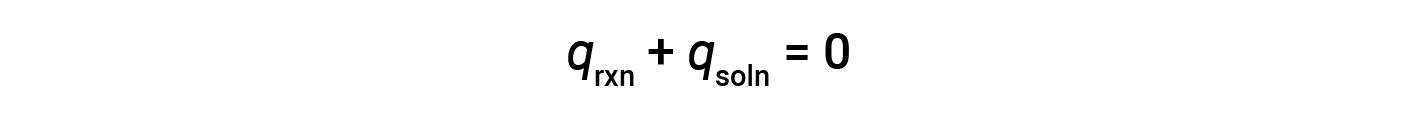
Isto significa que a quantidade de calor produzida ou consumida na reação é igual à quantidade de calor absorvida ou perdida pela solução:
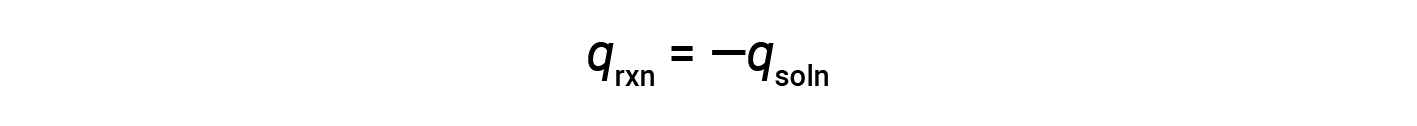
O calorímetro de xícara de café é um calorímetro de pressão constante, e o calor medido da reação é equivalente à alteração da entalpia.
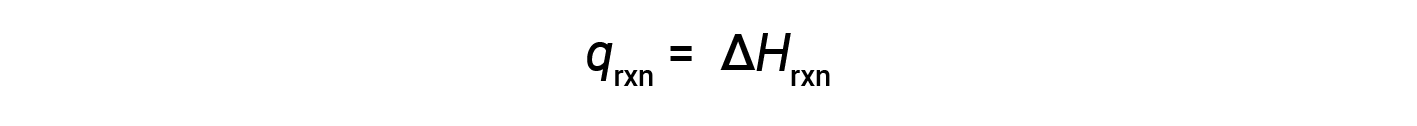
Este texto é adaptado de Openstax, Chemistry 2e, Section 5.2: Calorimetry.


