6.8:
일정 압력 열 계량법
6.8:
일정 압력 열 계량법
열량법은 화학적 또는 물리적 과정에 관련된 열의 양을 측정하거나 물질로 또는 물질로부터 전달되는 열을 측정하는 데 사용되는 기술입니다. 열은 열량계라는 보정 및 절연 장치와 교환됩니다. 열량 실험은 절연 열량계와 외부 환경 사이에 열 교환이 없다는 가정에 근거합니다. 잘 절연 된 열량계는 열량계와 외부 환경 사이의 열 전달을 방지하여 “주변 환경”을 열량계 내의 비시스템 구성 요소 (및 열량계 자체)로 효과적으로 제한합니다. 이를 통해 식품의 에너지 함량과 같은 화학 공정에 관련된 열을 정확하게 측정할 수 있습니다.
열량계에 의해 측정된 온도 변화는 연구 하에 있는 공정에 의해 전달되는 열의 양을 유도하는 데 사용됩니다. 열량계에서, 시스템은 화학적 또는 물리적 변화를 겪고 있는 물질 또는 물질로 정의되며, 즉, 반응 및 주변은 시스템에 열을 제공하거나 시스템에서 열을 흡수하는 열량계의 용액 및 기타 성분을 포함하는 다른 모든 물질이다.
화학 반응의 열량에 대해 논의하기 전에 열량의 핵심 아이디어를 설명하는 간단한 예제를 고려하십시오. 고온에서 뜨거운 금속 조각이 시원한 물과 같은 저온 물질에 배치되어 있다고 가정해 봅시다. 열은 뜨거운 금속에서 물로 흐르게 됩니다. 금속의 온도가 감소하고 두 물질이 동일한 온도를 가질 때까지 물의 온도가 증가합니다. 이 열계에서 발생하는 경우, 열의 모든 것은 외부 환경에 의해 얻거나 손실되지 않고, 두 물질 사이에 전달됩니다. 이러한 이상적인 상황에서 순 열 변화는 0입니다.
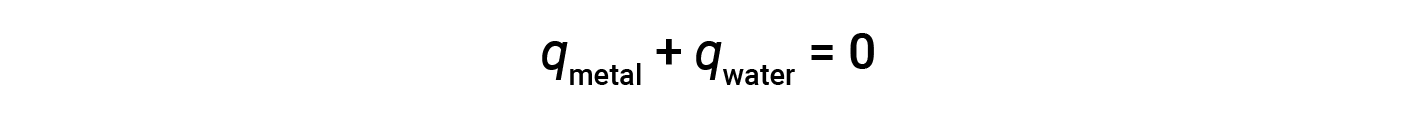
이 관계는 금속에 의해 얻은 열이 물질에 의해 손실 된 열과 같음을 보여주기 위해 재배열 할 수 있습니다.
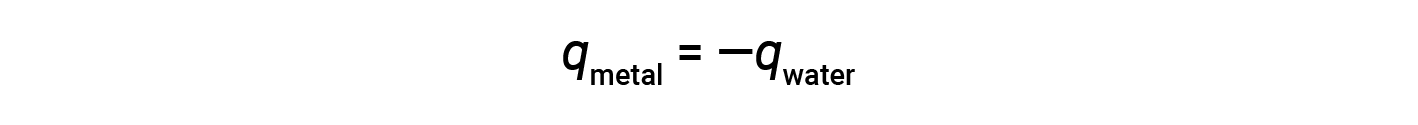
열의 크기 (변화)는, 따라서, 두 물질에 대해 동일합니다. 음수 기호는 단지 Q금속 및 q물이 열 흐름(이득 또는 손실)의 방향과 반대임을 나타내지만, (문제의 물질이 정의를 통해 열을 얻거나 잃는지 여부에 의해 결정되는) 어느 q 값의 산술 표시를 나타내지 않습니다. 설명된 특정 상황에서, q금속은 음수값이며, q물은 열이 금속에서 물로 전달되기 때문에 양수값이다.
화학 반응에 관련된 열을 결정하기 위해 칼로리를 사용하는 경우 동일한 원칙이 적용됩니다. 열량계에 흡수되는 열의 양은 종종 가장 자주 무시될 수 있을 만큼 작으며, 열량계는 외부 환경과의 에너지 교환을 최소화합니다. 열량계의 용액에서 외동 반응이 발생하면 반응에 의해 생성된 열이 용액에 흡수되어 온도가 증가합니다. 엔더럴 반응이 발생하면 필요한 열이 용액의 열 에너지로부터 흡수되어 온도가 떨어지게 됩니다. 온도 변화(ΔT)는용액(m soln)의 특정열(csoln)및 질량과 함께 두 경우 모두 관련된 열(qsoln)의양을 계산하는 데 사용될 수 있다.
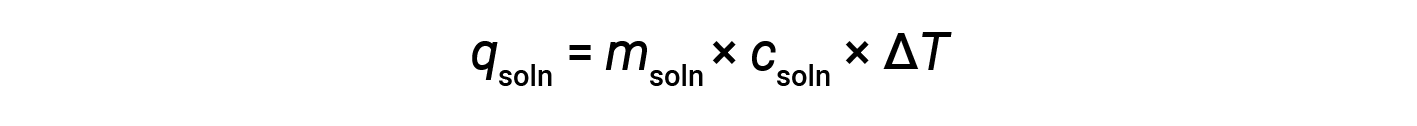
커피 컵 열량계라고 불리는 간단한 칼로리계는 느슨한 뚜껑으로 닫혀 있는 두 개의 중첩 폴리스티렌 컵으로 구성됩니다. 커피 컵 열량계는 솔루션(대부분 수성 솔루션)에서 일어나는 반응의 열을 측정하는 데 사용되며 부피 변화가 거의 또는 거의 없습니다. 에너지는 화학 반응 중에 생성되거나 파괴되지 않았기 때문에 반응(“시스템”), qrxn,용액(“주변”)에 의해 흡수되거나 손실된 열에서 생성되거나 소모된 열은 0까지 추가되어야 합니다.
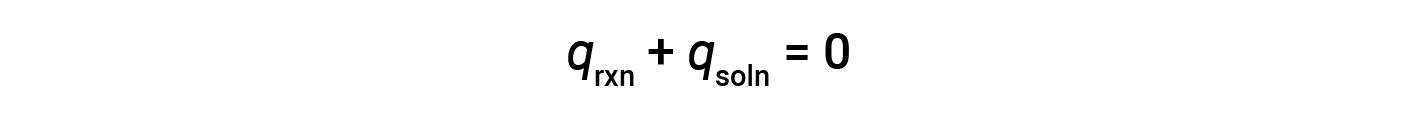
즉, 반응에서 생산되거나 소비되는 열의 양은 용액에 의해 흡수되거나 손실되는 열의 양과 같습니다.
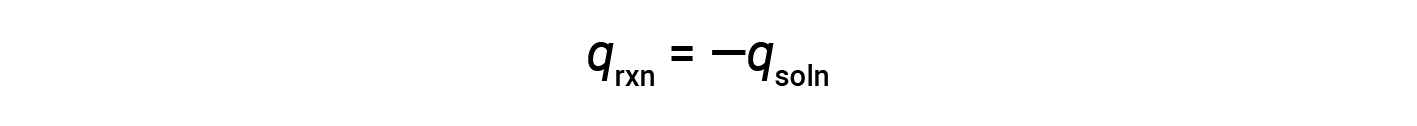
커피컵 열량계는 일정한 압력 열계이며, 반응의 측정된 열은 엔탈피의 변화와 동일합니다.
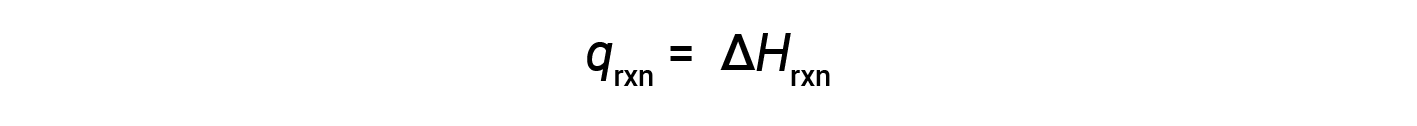
Suggested Reading
- Banna, M. Salim. "A heater for constant-pressure calorimetry." Journal of Chemical Education 63, no. 11 (1986): 997.
- Ruekberg, Ben. "An economical, safe, and sturdy student calorimeter." Journal of Chemical Education 71, no. 4 (1994): 333.
- Stankus, John J., and Jennifer D. Caraway. "Replacement of coffee cup calorimeters with fabricated beaker calorimeters." Journal of Chemical Education 88, no. 12 (2011): 1730-1731.
