6.10:
赫斯定律
电动汽车泄漏的氢气会 与大气中的臭氧层发生反应 产生水。对于这样的反应,在实验室中 直接测量焓的变化 是很困难的。然而,这种反应可以在 实验室分两步进行以测量 每一步的焓值。在步骤 1 中,氧气被转换成臭氧气体,ΔH_1等于 285.4 千焦耳。在步骤 2 中,氢气和氧气 结合产生水蒸气,ΔH_2 等于 483.6 千焦耳。由于焓是一个状态函数,反应的焓变化 只取决于系统的初始状态,氢和臭氧,以及最终状态,水,而不考虑中间步骤。赫斯恒热求和定律 指出如果一个化学方程可以 分多个步骤写出,那么该方程的净焓 变化可以写成与每个步骤 相关的焓之和。通常,必须对热化学反应 进行控制以使反应总和为一个给定的 反应。化学计量的量和反应的方向 可以改变并且每个操纵反应的 新焓都可以确定。在这个例子中,已知焓变化的两个步骤 不能直接相加来求出未知的 反应焓。这是因为第一个方程式 以臭氧为产物,而我们关注的反应 是以臭氧为反应物。为了解决这一问题,第一个方程,吸热反应,必须转换 成反向放热反应,即 臭氧分解成氧气,并释放 285.4 千焦耳的热量。新的 ΔH 具有相同的值,但符号相反。尽管如此,将步骤 1 和步骤 2 的逆向反应相加,并不能像在臭氧转化为水 的过程中那样产生 3 摩尔的水 因为两者的化学计量系数是不同的。为了解决这一问题,每个反应的 化学计量系数及其相关的 焓变必须乘以 使系数与所关注的反应相匹配 或相抵消的因子。因为焓变取决于反应物 和产物的量,所以系数 和焓变之间的比率保持不变。为了得到 3 摩尔的水,步骤 2 必须乘以 3 除以 2,得到新的 ΔH_2 为 725.4 千焦耳。为了消耗 1 摩尔的臭氧,步骤 1 的逆向反应 必须乘以 1 除以 2,得到新的 ΔH_1 为 142.7 千焦耳。将修正后的热化学方程求和 并取消反应物和产物中出现的所有 化合物,得到所关注的反应。当新的ΔH_1 和 ΔH_2 相加时,氢气与臭氧之间的反应的焓变 为 868.1 千焦耳。
6.10:
赫斯定律
有两种方法可以确定化学变化所涉及的热量:通过实验进行测量,或者根据其他通过实验确定的焓变化进行计算。有些反应很难甚至不可能进行调查,以进行准确的实验测量。而且即使在不难进行或测量反应的情况下,也可以方便地确定反应中涉及的热量而无需进行实验。
这种类型的计算通常涉及使用赫斯定律(Hess’s Law),该定律指出:如果一个过程可以写为几个逐步过程的总和,则总过程的焓变等于该过程的焓变总和。各个步骤。赫斯定律是有效的,因为焓是一种状态函数:焓的变化仅取决于化学过程的开始和结束位置,而不取决于化学过程从头到尾的过程。例如,碳与氧的反应形成二氧化碳的反应直接发生或通过两步过程发生。直接过程写为:
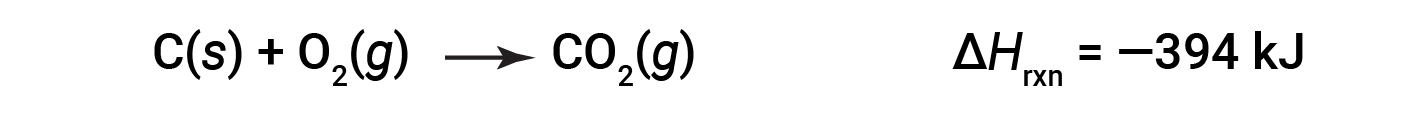
在两步过程中,首先形成一氧化碳:
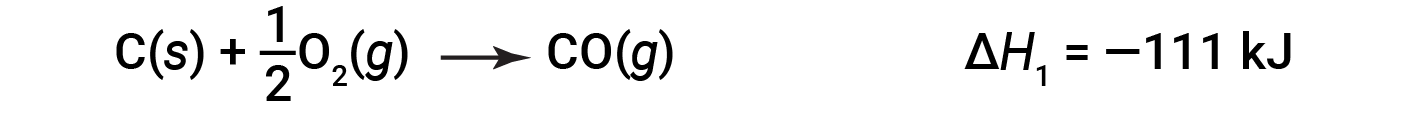
然后,一氧化碳进一步反应生成二氧化碳:
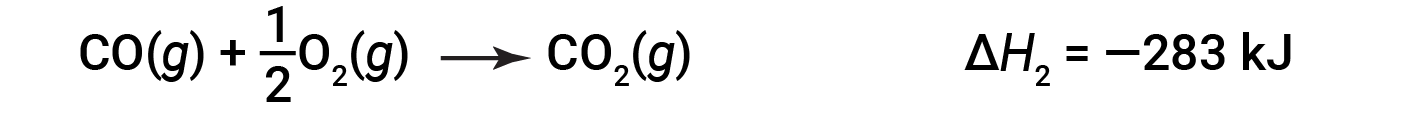
描述整个反应的方程式是这两个化学变化的总和:
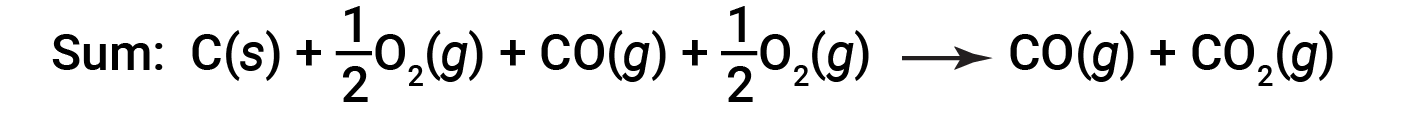
由于步骤2中消耗了步骤1中产生的一氧化碳,因此净变化为:

根据赫斯定律,反应的焓变将等于步骤的焓变之和。

Δ H 是相同的,而不管它是一步还是两步发生。对于化学和物理,这一发现(反应的总Δ H =整个反应的“步数”的Δ H 的总和)是正确的程序。
Δ H 的两个重要特征在使用赫斯定律解决问题时被证明是有用的。这是基于以下事实:Δ H 与反应物或产物的量成正比,并且以明确定义的方式改变反应(或热化学方程式)会改变Δ H 。
例如,形成1摩尔NO 2 ( g )的反应的焓变为+33.2 kJ:
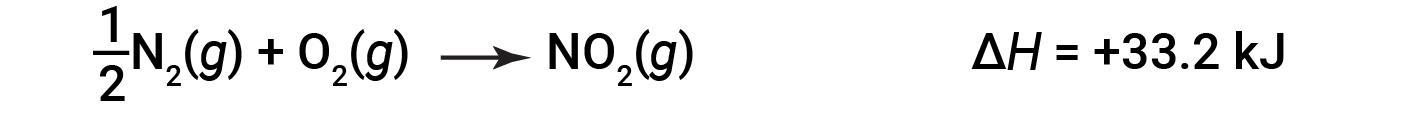
当形成2摩尔NO 2 (两倍)时,Δ H 的大小是原来的两倍:
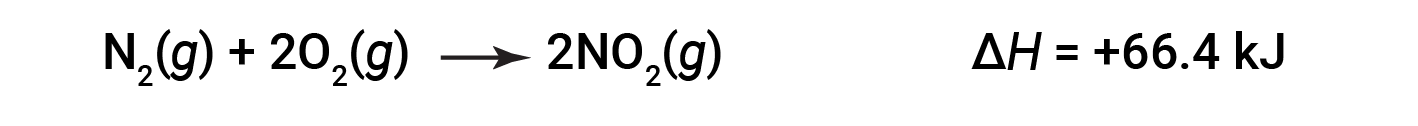
通常,如果将一个化学方程式相乘或相除,则焓变也应乘以或除以相同的数字。
一个方向上反应的Δ H 大小相等,符号相反,相反方向上的符号ΔH。例如:
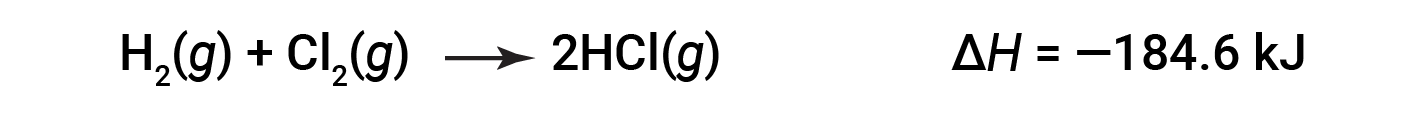
然后,对于逆反应,焓变也被逆转:
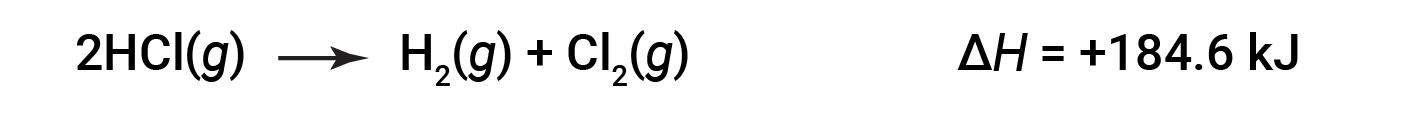
Suggested Reading
- Davis, Thomas W. "A common misunderstanding of Hess' law." Journal of Chemical Education 28, no. 11 (1951): 584.
- Lee, A. L., H. L. Feldkirchner, F. C. Schora, and J. J. Henry. "Heat of Reaction of Hydrogen and Coal." Industrial & Engineering Chemistry Process Design and Development 7, no. 2 (1968): 244-249.
