6.10:
헤스의 법칙
6.10:
헤스의 법칙
화학 적 변화에 관련된 열의 양을 결정하는 두 가지 방법이 있습니다 : 실험적으로 측정하거나 다른 실험적으로 결정된 엔탈피 변화에서 계산합니다. 일부 반응은 실험적으로 정확한 측정을 조사하고 하는 것이 불가능하지는 않더라도 어렵습니다. 그리고 반응이 수행하거나 측정하기 어렵지 않더라도 실험을 수행하지 않고도 반응에 관련된 열을 결정할 수 있는 것이 편리하다.
이러한 유형의 계산에는 일반적으로 헤스의 법칙을 사용하는 작업이 포함되며, 프로세스를 여러 단계별 프로세스의 합으로 작성할 수 있는 경우 총 프로세스의 엔탈피 변경은 다양한 단계의 엔탈피 변경 의 합계와 같습니다. 헤스의 법칙은 국가 기능이기 때문에 유효합니다: 엔탈피 변경은 화학 공정이 시작되고 끝나는 위치에만 의존하지만 처음부터 끝까지 걸리는 경로에는 적용되지 않습니다. 예를 들어, 이산화탄소를 형성하기 위해 산소를 가진 탄소의 반응은 직접 또는 2단계 공정에 의해 발생합니다. 직접 프로세스는 다음과 같이 작성됩니다.
2단계 공정에서 첫 번째 일산화탄소가 형성됩니다.
그런 다음 일산화탄소가 이산화탄소를 형성하기 위해 더 반응합니다.
전반적인 반응을 설명하는 방정식은 이 두 가지 화학 적 변화의 합계입니다.
1단계에서 생산되는 CO는 2단계에서 소비되므로 순 변경은 다음과 같은 것입니다.

헤스의 법칙에 따르면, 반응의 엔탈피 변경은 단계의 엔탈피 변화의 합계와 동일합니다.

전체 반응의 ΔH는 한 단계 또는 2단계에서 발생하는지 여부에 관계없이 동일합니다. 이 발견(전체 반응의 반응에 대한 전체 ΔH = 전체 반응의 반응 “단계”에 대한 ΔH 값의 합)은 화학 적 및 물리적 공정에 대해 일반적으로 사실입니다.
Hess의 법칙을 사용하여 문제를 해결하는 동안 유용하다는 것을 증명하는 ΔH의 두 가지 중요한 기능이 있습니다. 이는 ΔH가 반응물질 또는 제품의 수량에 직접적으로 비례하고, 반응(또는 열화학 방정식)을 선의로 변경하여 ΔH를 그에 따라 변화한다는 사실에 근거한다.
예를 들어, NO2(g)의1두더를 형성하는 반응에 대한 엔탈피 변화는 +33.2 kJ입니다.
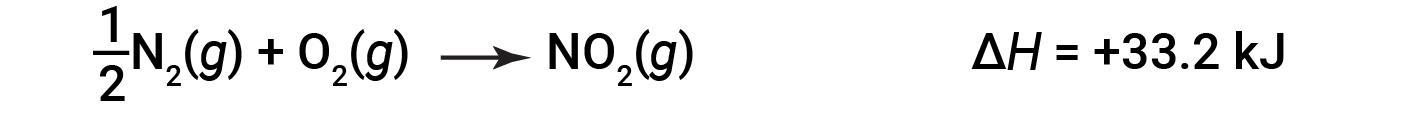
NO2의 두더지 2개(두 배)가 형성되면 ΔH가 두 배나 큽니다.
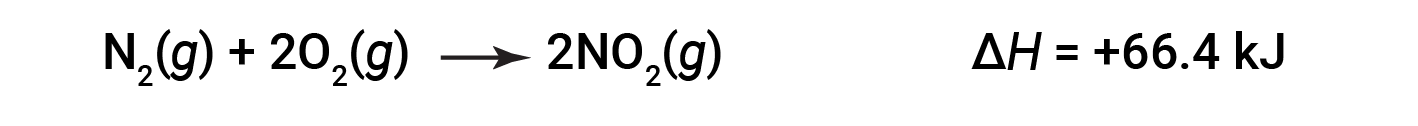
일반적으로 화학 방정식을 곱하거나 나누는 경우 엔탈피의 변화도 동일한 숫자로 곱하거나 분할되어야 합니다.
한 방향으로 반응에 대한 ΔH는 반대 방향으로 반응하기 위해 ΔH에 대한 기호의 크기와 반대가 동일하다. 예를 들어:
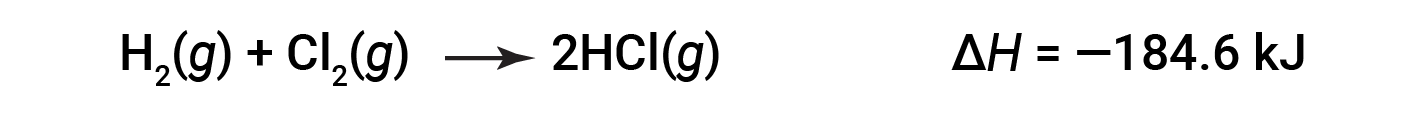
그런 다음 역반응의 경우 엔탈피 변경도 반전됩니다.
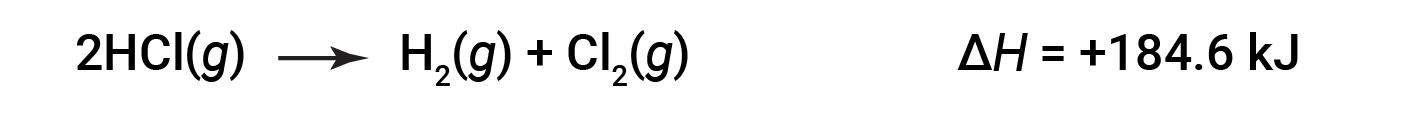
Suggested Reading
- Davis, Thomas W. "A common misunderstanding of Hess' law." Journal of Chemical Education 28, no. 11 (1951): 584.
- Lee, A. L., H. L. Feldkirchner, F. C. Schora, and J. J. Henry. "Heat of Reaction of Hydrogen and Coal." Industrial & Engineering Chemistry Process Design and Development 7, no. 2 (1968): 244-249.
