7.11:
원자 궤도(오비탈)
7.11:
원자 궤도(오비탈)
원자 궤도는 전자가 상주할 확률이 가장 높은 원자의 3차원 영역을 나타냅니다. 방사형 분포 기능은 핵으로부터의 거리 r에서 얇은 껍질 내에서 전자를 찾을 확률을 나타냅니다. 원자 궤도는 l,각 운동량 양자 수에 의해 결정되는 뚜렷한 모양을 가지고 있습니다. 궤도는 종종 구름의 가장 밀도가 높은 영역을 둘러싸고 경계 표면으로 그려집니다.
각 모멘텀 양자 번호는 값을 취할 수 있는 정수, l = 0, 1, 2, …, n – 1. 1(n=1)의 주 양자 수를 갖는 궤도는 l(l=0)의 단 하나의 값만 가질 수 있는 반면, 2(n=2)의 주 양자 수는 l= 0 및 l =1을 허용한다. l값이 동일한 궤도는 서브셸을 정의합니다.
l = 0의 궤도를 통해 소궤도라고 하며, 그들은 극의 서브쉘을 구성한다. 값 l = 1은 p 오비탈에 해당합니다. 주어진 n의경우 p 궤도는 p 서브쉘(즉,3p n = 3)을 구성한다. l = 2의 궤도를 d 궤도라고 합니다. l = 3, 4 및 5의 궤도는 f, g및 h 궤도입니다.
가장 낮은 에너지 궤도는1의 궤도입니다. 이것은 구형 대칭 궤도입니다. 1의 궤도의 확률 밀도(ψ2)는전자가 핵에서 발견될 가능성이 가장 높다는 것을 의미한다. 그러나 양성자와 전자 사이의 정전기력을 감안할 때 전자가 어디에 있는지 정확하게 나타내지는 않습니다. 대신, 방사형 분포 함수가 사용되며, 이는 지정된 반경 r에서궤도에서 전자를 찾을 확률의 총 확률의 플롯입니다. 방사형 분포 함수는 반디, r을가진 얇은 구형 쉘의 부피에 의해 확률 밀도를 곱하여 발견된다. 수소의1도궤도에 대해 방사형 분포 함수는 핵에서 값 0을 가지며, 이는 r증가로 감소하기 전에 52.9 picometer에서 최대로 증가합니다.
특정 궤도에 있는 전자를 찾는 확률 밀도가 0인 핵으로부터 특정 거리가 있습니다. 즉, 파장 ψ 값은 이 궤도의 이 거리에서 0입니다. 이러한 r 값을 방사형 노드라고 합니다. 궤도의 방사형 노드 수는 n – l – 1입니다. 2s 궤도의 경우 n = 1이 있는 방사형 노드가 하나 있는 반면3개의 궤도에는 두 개의 방사형 노드가 있습니다.
n = 2 이상의 각 주 수준은 세 개의 p 오비탈을 포함합니다. 세 개의 p 궤도에는 핵에 노드가 있는 두 개의 엽이 있습니다. 공간에서 p 궤도의 방향은 m l의값에 의해 설명된다. 세 개의 피 궤도는 서로 수직(직교)이다. 더 높은 p 궤도 (3p,4p,5p,및 더 높은)는 유사한 모양을 가지고 있지만 추가 방사형 노드와 크기가 더 큽니다.
n = 3 이상의 주 수준은 5d 궤도를 포함합니다. 이 궤도의 4개는 4개의 전자 조밀한 엽이 있는 클로버리프 모양으로 이루어져 있습니다. 핵에 교차하는 두 개의 수직 음달 평면이 있습니다. 이 노달 평면에서 전자 밀도는 0입니다. d 궤도 중 하나는 모양이 약간 다르며 xy 평면에 도넛 모양의 링이있는 z축에서 두 개의 엽이 있습니다. n = 4를 갖는 주수준은 복잡한 형상을 가진 7f 오비탈을 포함합니다. 이 궤도는 d 궤도보다 더 많은 노드와 로브를 가지고 있습니다.
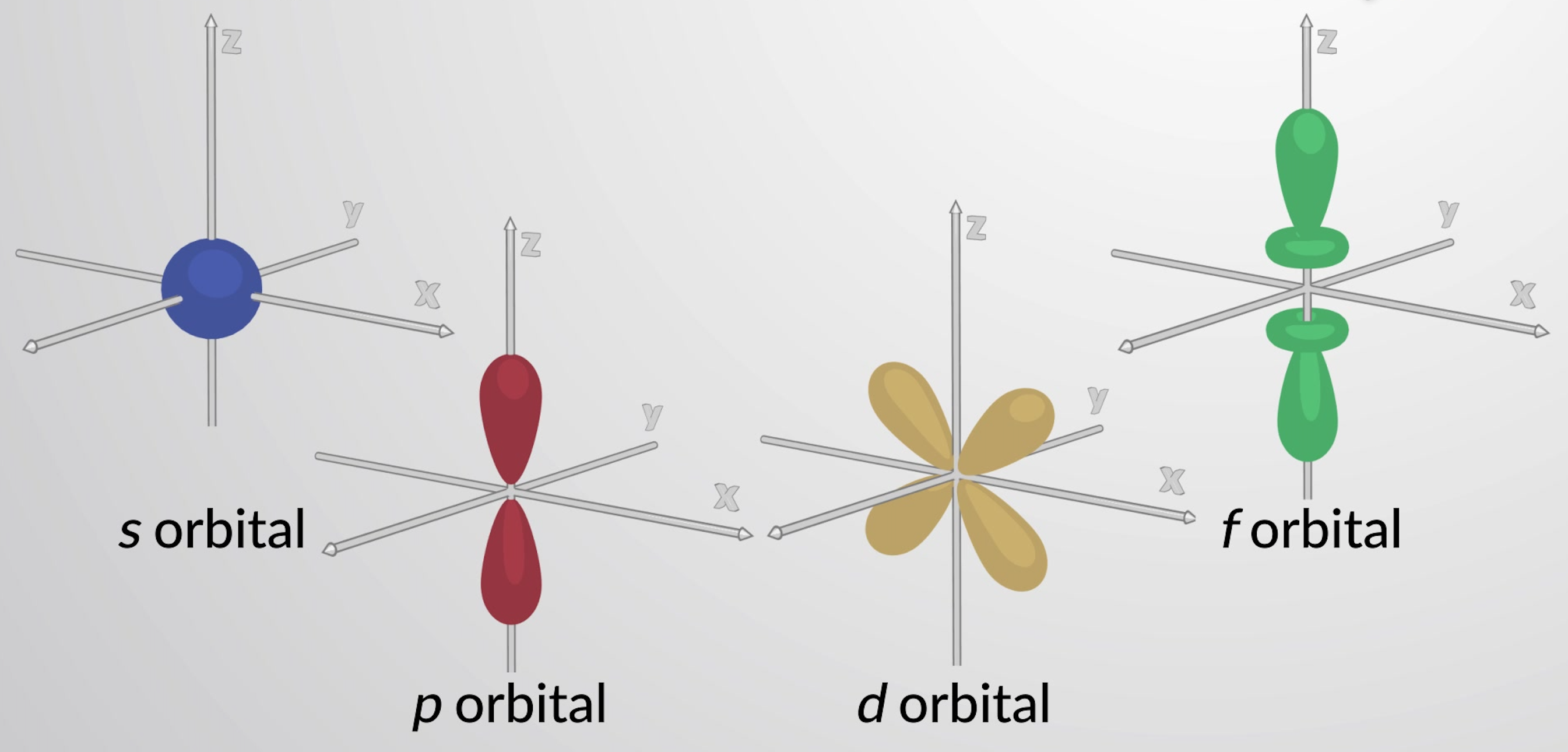
그림 1: 대표 s, p, d,그리고 f 궤도.
원자 궤도의 이러한 다른 모양은 전자가 발견 될 가능성이있는 3 차원 영역을 나타냅니다. 모든 궤도는 함께 대략 구형 모양을 구성, 원자는 일반적으로 구체로 표현되는 이유입니다.
