10.9:
分子轨道理论 II
10.9:
分子轨道理论 II
分子轨道能量图
原子和分子轨道的相对能量级别通常显示在分子轨道图中。 对于二原子分子,一个原子的原子轨道显示在左侧,另一个原子的 显示在右侧。 每条水平线代表一条可容纳两个电子的轨道。 由原子轨道组合形成的分子轨道显示在中央。 虚线显示了组成分子轨道的原子轨道组合。 对于每对组合在一起的原子轨道,将产生一个低能量 (键) 分子轨道和一个高能量 (反键) 轨道。
这些分子轨道中的电子分布是按照构造原理进行的。 低能量轨道首先填充;电子在配对前在去生轨道之间扩散,每个轨道最多可以容纳两个旋转相对的电子。
键级
填充的分子轨道图显示了键和反键分子轨道中的电子数量。 电子对分子键强的净贡献由确定键级识别。 在分子轨道模型中,如果电子键占据了一个键轨道交互,那么它会对该交互产生影响,如果电子占据了一个反键轨道,它会对反键交互产生影响。 键级的计算方法是从稳定 (键) 电子中减去破坏稳定 (反键) 电子。 由于键由两个电子组成,我们除以两个以获得键级。 确定键级的公式如下:
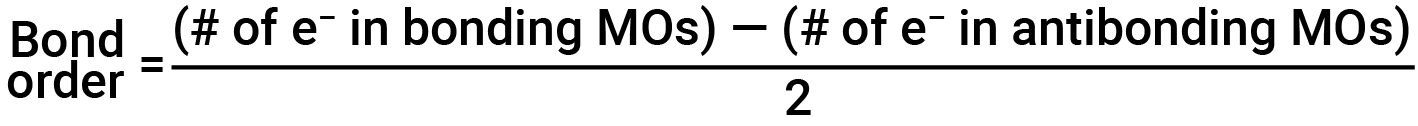
键级是共价键强度的指南;随着键级的增加,两个给定原子之间的键会变得更强。 如果分子轨道中的电子在两个原子之间的分布使得产生的键的键级为零,那么稳定的键就不会形成。
核苷二原子分子中的键
一个氢分子(H2) 由两个氢原子形成。 当两个原子的原子轨道结合时,电子占据了最低能量的分子轨道,即 σ1s 键轨道。 由于H2分子的能量低于两个 H 原子的 ,因此氢二分子 H2 容易形成。 H2 分子中的两个电子均为 σ1s 键轨道;电子配置为 (σ1s)2。 这种配置由分子轨道能量图表示,其中单个向上箭头表示轨道中的一个电子,两个 (向上和向下) 箭头表示两个反向旋转的电子。 二氢分子含有两个键电子,没有反键电子,因此键级等于 1。 因此, H – H 键是一个单键。
氦原子有两个电子,它们都在 1s 轨道中。 两个氦原子不会与四个电子组合形成氦分子He2,因为两个电子在低能量键轨道中的稳定效应将被两个电子在高能量反键分子轨道中的破坏稳定效应抵消。 He2的假设电子配置为 (σ1s)2(σ*1s)2。 假设氦分子中的键级为零。 这表明两个氦原子之间没有形成键。
第二个周期的核苷酸二原子分子中的键
元素周期表第二个周期的原子可能形成八个可能的同核二原子分子: Li2, Be2, B2, C2, N2, O2, F2, and Ne2。 由于键级为零, Be2 分子和Ne2 分子将不稳定。
对于价分子轨道电子配置,价电子被分配给能量尽可能低的价分子轨道。 与 洪德规则(Hund’s rules) 一致,只要有两个或更多的去生分子轨道,电子就会在电子配对发生之前均匀填充该类型的每一个轨道。
σ 轨道通常比 π 轨道更稳定。 但是,情况并非总是如此。对于 p 轨道 (Li 至 N) 中有三个或三个以下电子的原子,观察到一种不同的模式,即 σp 轨道在能量中高于πp设置。
轨道排序中的这种切换是由于称为s–p 混合的现象而发生的。s–p 混合不会产生新的轨道;它只是影响现有分子轨道的能量。 σs波函数以数学方式与 σp 波函数结合,结果 σs 轨道变得更加稳定, σp 轨道变得更不稳定。 同样,反键轨道也经历了s–p 混合, σs* 变得更加稳定,σp* 变得越来越不稳定。
当s和 p 轨道具有相似的能量时,就会发生s–p混合。在 O,F和 Ne 中,2s 和 2p轨道之间的能量差大于 Li ,Be ,B ,C 和 N。 因此,O2, F2, 和 Ne2 的s–p混合可忽略不计 (不足以更改能量排序) , 他们的分子轨道图(MO图) 遵循正常模式,如上图所示。所有其他的 2 期二原子分子都有s–p混合,这会导致 σp 轨道升高到 πp 组以上的模式。
