11.7:
相転移:気化と凝縮
A subscription to JoVE is required to view this content. Sign in or start your free trial.
JoVE Core
Chemistry
Phase Transitions: Vaporization and Condensation
In a liquid, when the thermal motions of molecules overcome the intermolecular forces holding them together, the molecules break free and enter the gas state. This transition from liquid to gas is known as vaporization and can occur under two conditions: non-boiling or boiling. Under the non-boiling condition, vaporization occurs only at the surface and below the liquid’s boiling point. This is called surface evaporation and occurs without the formation of vapor bubbles in the bulk liquid. In contrast, if vaporization occurs at the liquid’s boiling point, vapor bubbles form in the bulk liquid, and the process is called boiling. Boiling is not a surface phenomenon and occurs at all points inside the liquid. Vaporization is a temperature-dependent endothermic process: the greater the heat supplied, the higher the vaporization rate. The amount of energy required to vaporize one mole of a liquid is called its molar heat of vaporization or its molar enthalpy of vaporization. As vaporization is an endothermic process, its enthalpy value is always positive. Intermolecular forces influence the molar enthalpy of vaporization. For instance, due to the strong network of hydrogen bonds between water molecules, one mole of water requires a substantial amount of heat energy — around 40.65 kilojoules — to transform into water vapor. In comparison, the weaker dipole–dipole forces between acetone molecules can be overcome with merely 31.3 kilojoules per mole of heat energy. The reverse of vaporization, that is, the transition from gas to liquid, is called condensation. When gas molecules collide with cooler liquid or solid surfaces, they lose heat. Multiple collisions result in a significant loss of heat, and the molecules ultimately condense. Condensation is, therefore, an exothermic process. Although the enthalpy of condensation is negative, its magnitude is the same as the enthalpy of vaporization. When the opposing transitions — vaporization and condensation — occur in a closed system, the system reaches a state of dynamic equilibrium called the vapor–liquid equilibrium.
11.7:
相転移:気化と凝縮
温度を変えると物質の物理的な形態が変化します。例えば、液体の温度を上げると、液体が気化します(蒸気に変わる)。この現象は気化と呼ばれ、表面の現象です。気化は、分子の熱運動が分子間力に打ち勝って、(表面の)分子が気体状態に逃げ出すことで起こります。密閉された容器の中で液体が気化するとき、気体の分子は逃げられません。気相の分子がランダムに動き回ると、時折、凝縮相の表面に衝突し、場合によってはその衝突によって分子が再び凝縮相に入ることになります。このような気相から液体への変化を「凝縮」といいます。
気化は吸熱性のプロセスです。冷却効果は、水泳やシャワーの後に顕著に現れます。皮膚に付着した水が蒸発すると、皮膚から熱が奪われ、皮膚が冷やされます。気化プロセスに伴うエネルギー変化は、気化のエンタルピー、 ΔHvap です。例えば、標準温度での水の気化は次のように表されます。

吸熱過程の逆は発熱過程です。つまり、気体が凝縮すると熱が発生します。
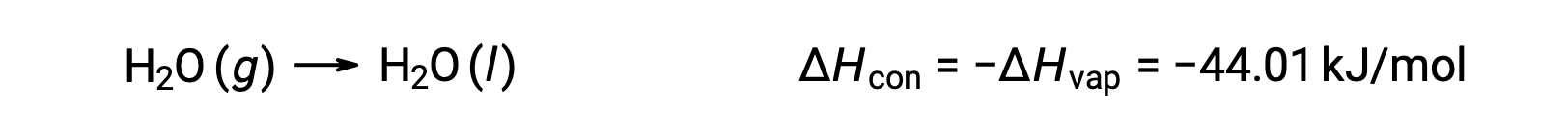
気化と凝縮は反対のプロセスであるため、それぞれのエンタルピー値は符号が逆の同一の値となります。気化のエンタルピーが正であるのに対し、凝縮のエンタルピーは負です。
物質によって気化の度合いが異なるため(IMFの強さによる)、気化のエンタルピーの値も異なります。分子間の引力が比較的強い場合は、気化エンタルピーの値が高くなります。弱い分子間引力では、気化の障壁が少なく、気化エンタルピーの値は比較的低くなります。
このテキストは、 Openstax 、 Chemistry 2e 、 Section 10.3 : Phase Transitions から引用しています。
