11.7: انتقالات المرحلة: التبخير والتكثيف
يتغير الشكل المادي للمادة عند تغيير درجة حرارتها. على سبيل المثال ، يؤدي رفع درجة حرارة السائل إلى تبخر السائل (يتحول إلى بخار). وتسمى هذه العملية بالتبخير— ظاهرة سطحية. يحدث التبخر عندما تتغلب الحركة الحرارية للجزيئات على القوى بين الجزيئات، وتهرب الجزيئات (الموجودة على السطح) إلى الحالة الغازية. وعندما يتبخر السائل في حاوية مغلقة، لا يمكن لجزيئات الغاز الهروب. نظراً لأن جزيئات الطور الغازي هذه تتحرك بشكل عشوائي حول، فإنها يصطدم أحيانًا بسطح المرحلة المكثفة ، وفي بعض الحالات ، ستؤدي هذه الاصطدامات إلى إعادة دخول الجزيئات إلى الطور المكثف. يسمى التغيير من الطور الغازي إلى السائل بالتكثيف.
التبخير عملية ماصة للحرارة. يظهر تأثير التبريد بعد السباحة أو الاستحمام. عندما يتبخر الماء الموجود على الجلد ، يزيل الحرارة من الجلد ويبرد الجلد. إن تغير الطاقة المرتبط بعملية التبخير هو المحتوى الحراري للتبخير، ΔHvap. على سبيل المثال، يتم تمثيل تبخير الماء عند درجة حرارة قياسية بما يلي:

عكس العملية الماصة للحرارة هو طارد للحرارة. وهكذا، فإن تكثيف الغاز يطلق حرارة:
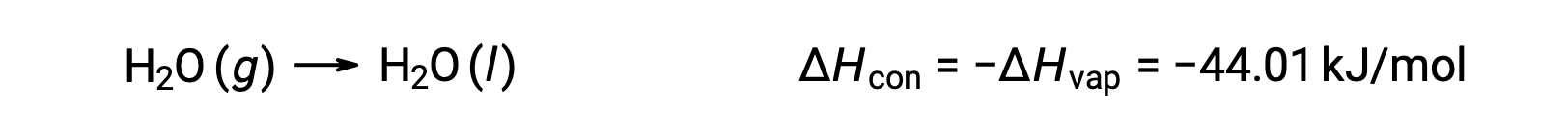
التبخير والتكثيف عمليتان متعارضتان؛ وبالتالي، فإن قيم المحتوى الحراري الخاصة بهم متطابقة مع الإشارات المعاكسة. في حين أن المحتوى الحراري للتبخير موجب ، فإن المحتوى الحراري للتكثف يكون سالبًا.
تتبخر المواد المختلفة بدرجات مختلفة (اعتمادًا على نقاط القوة في IMFs الخاصة بها) وبالتالي تعرض محتوى حراريًا مختلفًا لقيم التبخير. تؤدي قوى الجذب بين الجزيئات القوية نسبيًا بين الجزيئات إلى زيادة المحتوى الحراري لقيم التبخر. تمثل عوامل الجذب بين الجزيئات الضعيفة حاجزًا أقل للتبخر ، مما ينتج عنه قيم منخفضة نسبيًا من المحتوى الحراري للتبخر.
هذا النص مقتبس من Openstax, Chemistry 2e, Section 10.3: Phase Transitions.


