11.7:
Transições de Fase: Vaporização e Condensação
11.7:
Transições de Fase: Vaporização e Condensação
A forma física de uma substância altera-se ao alterar a sua temperatura. Por exemplo, aumentar a temperatura de um líquido faz com que o líquido vaporize (se converta em vapor). O processo é chamado de vaporização—um fenómeno de superfície. A vaporização ocorre quando o movimento térmico das moléculas supera as forças intermoleculares e as moléculas (à superfície) escapam para o estado gasoso. Quando um líquido vaporiza em um recipiente fechado, as moléculas de gás não podem escapar. À medida que estas moléculas de fase gasosa se movem aleatoriamente, elas vão ocasionalmente colidir com a superfície da fase condensada e, em alguns casos, essas colisões resultarão na reentrada das moléculas na fase condensada. A mudança de fase gasosa para líquida é denominada condensação.
A vaporização é um processo endotérmico. O efeito de arrefecimento é evidente após um banho ou duche. Quando a água na pele evapora, remove o calor da pele e arrefece a pele. A mudança de energia associada ao processo de vaporização é a entalpia de vaporização, ΔHvap. Por exemplo, a vaporização da água à temperatura padrão é representada por:

O inverso de um processo endotérmico é exotérmico. Portanto, a condensação de um gás liberta calor:
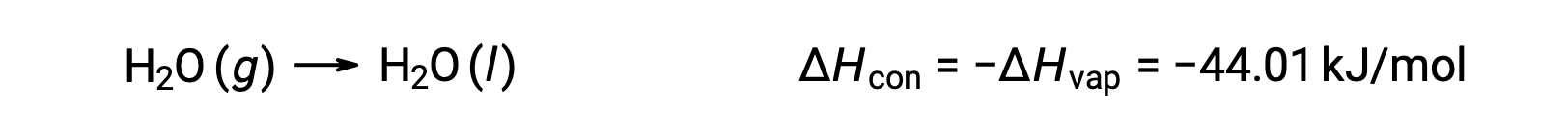
A vaporização e a condensação são processos opostos; consequentemente, os seus valores de entalpia são idênticos com sinais opostos. Enquanto que a entalpia da vaporização é positiva, a entalpia da condensação é negativa.
Diferentes substâncias vaporizam em diferentes extensões (dependendo das forças das suas FIMs) e, por conseguinte, apresentam diferentes valores de entalpia de vaporização. Forças intermoleculares de atração relativamente fortes entre moléculas resultam em maiores valores de entalpia de vaporização. Atrações intermoleculares fracas apresentam menos barreira à vaporização, produzindo valores relativamente baixos de entalpias de vaporização.
Este texto é adaptado de Openstax, Chemistry 2e, Section 10.3: Phase Transitions.
