11.7:
相变:汽化和凝结
A subscription to JoVE is required to view this content. Sign in or start your free trial.
JoVE Core
Chemistry
Phase Transitions: Vaporization and Condensation
在液体中,当分子的热运动 克服了将分子保持在一起的分子间作用力时,分子就会摆脱束缚,并进入气态。这种从液体到气体的转变称为蒸发,可以在两种情况下发生:不沸腾或沸腾。在非沸腾情况下,蒸发 只发生在液体的表面和 沸点以下。这叫做表面蒸发,在液相本体中 不会形成汽泡的情况下发生。相比之下,如果在液体的沸点下发生蒸发,则在液相本体中会形成汽泡,该过程称为沸腾。沸腾不是表面现象,而是发生在液体内部的所有位置。蒸发是一个依赖于温度的 吸热过程:提供的热量越大,蒸发速率越高。蒸发一摩尔液体所需的能量 称为摩尔蒸发热 或摩尔蒸发焓。由于蒸发是吸热过程,因此其焓值始终为正。分子间作用力会影响 摩尔蒸发焓。例如,由于水分子之间存在牢固的氢键网络,一摩尔水需要 大量的热能 约 40.65 千焦耳)才能转化为水蒸气。相比之下,丙酮分子之间较弱的偶极-偶极力 只需每摩尔热能 31.3 千焦耳 就可以克服。蒸发的逆过程 即从气体到液体的转变)称为冷凝。当气体分子与较冷的液体或固体表面碰撞时,它们会失去热量。多次碰撞导致大量的热量流失,分子最终凝结。因此,冷凝是放热过程。尽管冷凝焓为负,但其大小与蒸发焓相同。当在一个封闭系统中发生相反的转变(蒸发和冷凝)时,系统达到一种称为汽液平衡的 动态平衡状态。
11.7:
相变:汽化和凝结
物质的物理形式随温度的变化而变化。 例如,提高液体温度会导致液体汽化 (转化为蒸汽)。 这一过程称为汽化—一种表面现象。 当分子的热运动克服了分子间作用力,而分子 (在表面) 进入气态时,就会发生汽化。 当液体在封闭容器中蒸发时,气体分子就无法逸出。 随着这些气相分子随机移动,它们偶尔会与凝相表面发生碰撞,在某些情况下,这些碰撞会导致分子重新进入凝相。 从气体相向液体的变化称为凝结。
汽化是一个内置治疗过程。 游泳或淋浴后,冷却效果明显。 当皮肤上的水蒸发时,它会除去皮肤的热量并冷却皮肤。 与汽化进程相关的能量更改是汽化的焓, ΔHvap。 例如,标准温度下的水汽化由以下项表示:

同发性过程相反的是放热。 因此,气体的凝结释放热量:
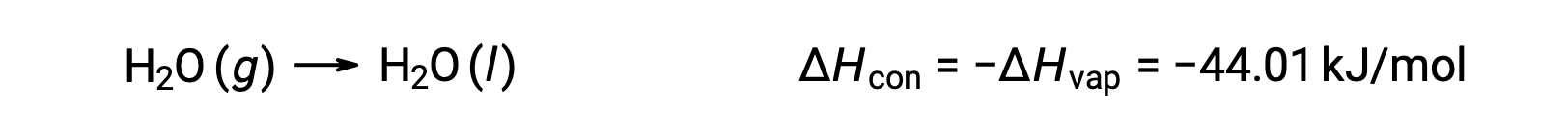
汽化和凝结是相反的过程;因此,它们的焓值与相反。 虽然汽化的焓为正,但凝结的焓为负。
不同的物质会蒸发到不同的范围 (取决于其 分子间力(IMFs) 的强度) ,因此会显示不同的汽化值焓。 分子之间相对较强的分子间有吸引力的力会导致汽化值的焓更高。 弱分子间吸引力对汽化的障碍较小,导致汽化的焓值相对较低。
本文改编自 Openstax, 化学 2e, 第10.3节:相变。
