11.7:
Transiciones de Fase: Vaporización y Condensación
11.7:
Transiciones de Fase: Vaporización y Condensación
La forma física de una sustancia cambia al cambiar su temperatura. Por ejemplo, el aumento de la temperatura de un líquido hace que éste se evapore (se convierta en vapor). El proceso se llama vaporización, un fenómeno de superficie. La vaporización se produce cuando el movimiento térmico de las moléculas supera las fuerzas intermoleculares y las moléculas (en la superficie) se escapan al estado gaseoso. Cuando un líquido se evapora en un recipiente cerrado, las moléculas de gas no pueden escapar. A medida que estas moléculas de fase gaseosa se mueven aleatoriamente, chocan ocasionalmente con la superficie de la fase condensada y, en algunos casos, estas colisiones darán lugar a que las moléculas vuelvan a entrar en la fase condensada. El cambio de la fase gaseosa a la líquida se denomina condensación.
La vaporización es un proceso endotérmico. El efecto refrescante es evidente después de nadar o ducharse. Cuando el agua de la piel se evapora, elimina el calor de la piel y la enfría. El cambio de energía asociado con el proceso de vaporización es la entalpía de la vaporización, ΔHvap. Por ejemplo, la vaporización del agua a temperatura estándar se representa mediante:

El inverso de un proceso endotérmico es exotérmico. Y así, la condensación de un gas libera calor:
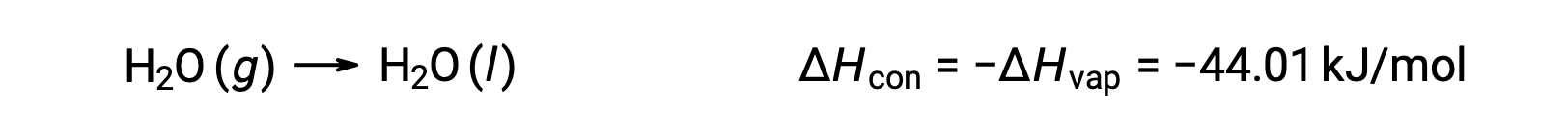
La vaporización y la condensación son procesos opuestos; por consiguiente, sus valores de entalpía son idénticos pero con signos opuestos. Mientras que la entalpía de la vaporización es positiva, la entalpía de la condensación es negativa.
Las diferentes sustancias se vaporizan en diferentes grados (dependiendo de las intensidades de sus FIMs) y por lo tanto muestran diferentes valores de entalpía de vaporización. Las fuerzas intermoleculares relativamente fuertes entre moléculas resultan en valores de entalpía de vaporización más altos. Las atracciones intermoleculares débiles presentan menos obstáculos para la vaporización, produciendo valores relativamente bajos de entalpías de vaporización.
Este texto es adaptado de Openstax, Química 2e, Sección 10.3: Transiciones de Fase.
