11.7:
상전이: 기화와 응축
A subscription to JoVE is required to view this content. Sign in or start your free trial.
JoVE Core
Chemistry
Phase Transitions: Vaporization and Condensation
액체에서 분자의 열적 이동이 분자를 붙잡고 있는 분자간 힘을 극복할 때 분자들은 자유로워지고 기체 상태로 들어갑니다. 액체에서 기체로의 이러한 전이를 기화라고 하며 끓지 않는 상태와 끓는 상태의 두 가지 조건에서 발생할 수 있습니다. 끓지 않는 조건 하에서 기화는 표면에서 액체의 끓는점 아래에서만 발생합니다.이것을 표면 증발이라고 하며 대량 액체에서 증기 거품이 형성되지 않고 발생합니다. 반대로 액체의 끓는점에서 기화가 발생하면 다량의 액체에 증기 거품이 생기며 그 과정을 끓음이라고 합니다. 끓음은 표면에서 나타나는 현상이 아니며 액체 내부의 모든 위치에서 발생합니다.기화는 온도에 따라 달라지는 흡열성 과정입니다. 즉 열이 더 많이 가해질수록 기화율이 더 높습니다. 일 몰의 액체를 기화하는 데 필요한 에너지의 양은 기화의 몰 열 또는 기화의 몰 엔탈피라고 불립니다.기화는 흡열 과정이기 때문에 엔탈피 값은 항상 양수입니다. 분자간 힘은 기화의 몰 엔탈피에 영향을 미칩니다. 예를 들어 물 분자들 사이의 수소 결합이 강하게 연결되어 있기 때문에 일 몰의 물은 수증기로 변하기 위해 약 40.65 킬로줄 정도의 상당한 양의 열에너지를 필요로 합니다.그에 비해 아세톤 분자 사이의 약한 쌍극자-쌍극자 힘은 열에너지의 몰 당 31.3 킬로줄의 열 에너지가 있어야 극복될 수 있습니다. 기화의 가역 과정 즉 기체에서 액체로의 전이는 응축이라고 불립니다. 기체 분자가 냉각된 액체나 고체 표면과 충돌하면 열을 잃게 됩니다.다중 충돌에 의해 상당한 열 손실이 초래되며 결과적으로 분자는 응축됩니다. 그러므로 응축은 발열 과정입니다. 응축의 엔탈피는 음수이지만 그 크기는 기화 시의 엔탈피와 같습니다.서로 반대되는 전이 즉 기화와 응축이 닫힌계에서 발생하면 계는 증기 액체 평형이라고 불리는 동적인 평형 상태에 도달합니다
11.7:
상전이: 기화와 응축
물질의 물리적 형태는 온도를 변경에 변경됩니다. 예를 들어, 액체의 온도를 높이면 액체가 기화(증기로 변환)됩니다. 이 프로세스를 기화라고 합니다. 기화는 분자의 열 운동이 분자 간 힘을 극복할 때 발생하며 분자(표면에서)가 기체 상태로 빠져나갑니다. 액체가 밀폐된 용기에서 기화하면 가스 분자는 탈출할 수 없습니다. 이러한 가스 상 분자에 대해 무작위로 이동 으로, 그들은 때때로 응축 된 단계의 표면과 충돌 하 고 어떤 경우에, 이러한 충돌 은 분자 응축 된 단계에 다시 입력 귀 착될 것 이다. 가스 상에서 액체로의 변경은 응축이라고 합니다.
기화는 풍등처리이다. 수영이나 샤워 후 냉각 효과가 분명합니다. 피부의 물이 증발하면 피부에서 열을 제거하고 피부를 식힙니다. 기화 공정과 관련된 에너지 변화는 기화, ΔHvap의엔탈피이다. 예를 들어, 표준 온도에서 물의 기화는 다음과 같은 것으로 표시됩니다.

풍체 과정의 반대는 외설적이다. 그래서, 가스의 응축은 열을 방출 :
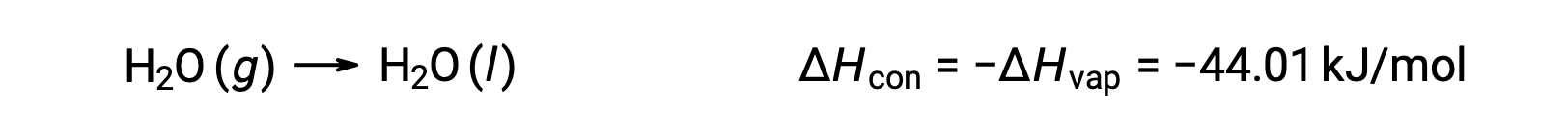
기화 및 응축은 반대 되는 프로세스; 따라서 엔탈피 값은 반대 징후와 동일합니다. 기화의 엔탈피는 긍정적이지만 응축의 엔탈피는 부정적입니다.
다른 물질은 다른 범위 (그들의 IMFs의 강점에 따라) 기화 하 고 따라서 기화 값의 다른 엔탈피를 표시. 분자 간의 상대적으로 강한 분자 간 매력적인 힘은 기화 값의 더 높은 엔탈피를 초래합니다. 약한 분자 간 매력은 기화에 대한 장벽이 적어 기화의 엔탈피의 상대적으로 낮은 값을 산출합니다.
