11.15:
Sólidos Moleculares e Iónicos
11.15:
Sólidos Moleculares e Iónicos
Los sólidos cristalinos se dividen en cuatro tipos: Redes moleculares, iónicas, metálicas y covalentes basado en el tipo de unidades constituyentes y sus interacciones entre partículas.
Sólidos moleculares
Los sólidos cristalinos moleculares, como el hielo, la sacarosa (azúcar de mesa) y el yodo, son sólidos compuestos de moléculas neutras como sus unidades constituyentes. Estas moléculas están unidas por fuerzas intermoleculares débiles como las fuerzas de dispersión de London, las interacciones dipolo-dipolo o los puentes de hidrógeno, que dictan sus propiedades (Tabla 1).
Las fuerzas de atracción entre las unidades presentes en los diferentes cristales varían ampliamente, lo que se refleja en los puntos de fusión de tales cristales.
• Pequeñas moléculas no polares simétricas, como H2, N2, O2 y F2, Tienen fuerzas de dispersión débiles y forman sólidos moleculares con puntos de fusión muy bajos (por debajo de −200 °C). Las sustancias que consisten en moléculas más grandes y no polares tienen fuerzas de atracción más grandes y se funden a temperaturas más altas.
• Los sólidos moleculares compuestos de moléculas polares con momentos dipolo permanentes se funden a temperaturas aún más altas. Los ejemplos incluyen el sólido SO2 y el azúcar de mesa. El enlace intermolecular de hidrógeno es principalmente responsable de mantener el entramado tridimensional de tales sólidos moleculares, como se ve en el agua congelada o hielo.
Las propiedades de los sólidos moleculares dependen del empaquetamiento eficiente de sus unidades constituyentes, las moléculas, en tres dimensiones. Dado que las fuerzas intermoleculares dependen del contacto, una mayor simetría de las moléculas constituyentes garantiza un empaquetamiento estrecho y compacto dentro de la estructura cristalina con altas atracciones intermoleculares. Esto aumenta el punto de fusión. La menor simetría de las moléculas impide su empaquetamiento eficiente. Las fuerzas intermoleculares, por lo tanto, no son tan efectivas, y el punto de fusión es más bajo.
Sólidos iónicos
Los sólidos cristalinos iónicos, como el cloruro de sodio, se componen de iones positivos y negativos que se mantienen unidos por fuertes atracciones electrostáticas.
Los sólidos iónicos tienen altos puntos de fusión debido a las fuertes atracciones iónicas. La fuerza de la interacción iónica entre los cationes y los aniones en un sólido iónico se puede aproximar mediante la fuerza electrostática, dada por la ley de Coulomb:
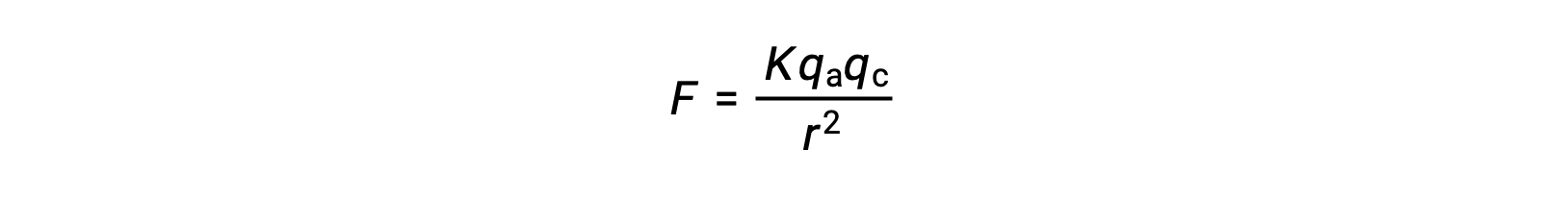
Aquí, K es una constante de proporcionalidad, r es la distancia entre las cargas, yqa y qc representan las cargas sobre los aniones y cationes, respectivamente. A mayor carga en los cationes y aniones, mayor es la fuerza de atracción iónica. Del mismo modo, el empaquetado estrecho de los aniones y cationes en el entramado de cristal reduce la distancia entre las cargas, resultando en mayores fuerzas de atracción iónica.
Los sólidos iónicos son duros, también tienden a ser frágiles, y se rompen en lugar de doblarse. Su fragilidad se atribuye a la presencia de interacciones atractivas (catión-anión) y repulsivas (catión-catión y anión-anión) en la celosía cristalina. Como los iones son incapaces de moverse libremente debido a las fuertes fuerzas coulombicas, los sólidos iónicos no conducen electricidad. Sin embargo, en el estado fundido o cuando se disuelven en el agua, los iones se liberan para moverse y conducir electricidad.
Tabla 1. Características de los sólidos moleculares e iónicos.
| Tipo de sólido cristalino | Tipo de partícula constituyente | Tipo de atracciones | Propiedades | Ejemplos |
| Sólidos moleculares | Moléculas | Fuerzas intermoleculares (FIMs): Fuerzas de dispersión, fuerzas dipolo-dipolo, puentes de hidrógeno | dureza variable, fragilidad variable, puntos de fusión bajos, mal conductor del calor y la electricidad | Ar, H2O (hielo), CO2 (hielo seco), I2, C12H22O11 (sacarosa)
|
| Sólidos iónicos | Iones | Electrostática | duro, frágil, puntos de fusión altos a muy altos, conductor de electricidad en estado fundido y disuelto | NaCl (sal de mesa), MgO (óxido de magnesio), Al2O3 (alúmina) |
Parte de este texto ha sido adaptado de Openstax, Química 2e, Sección 10.5: El Estado Sólido de la Materia.
