11.15:
분자성 고체와 이온성 고체
11.15:
분자성 고체와 이온성 고체
결정성 고형은 분자, 이온, 금속 및 계주 네트워크의 구성 단위 유형 및 입자 간 상호 작용의 네 가지 유형으로 나뉩니다.
분자 고형체
얼음, 자당(테이블 설탕), 요오드와 같은 분자 결정성 고형체는 중성 분자로 구성된 고형체입니다. 이 분자는 그들의 속성을 지시하는 런던 분산 힘, 이폴 이폴 상호 작용, 또는 수소 결합과 같은 약한 분자 간 힘에 의해 함께 개최됩니다 (표 1).
다른 결정에 존재하는 단위 사이의 매력적인 힘의 강점은 이러한 결정의 용융점에 반영되는 매우 다양합니다.
• H2,N 2, O2및F2와같은 작은 대칭 비극성 분자는 약한 분산력을 가지며 매우 낮은 융점 (-200 °C 이하)을 갖는 분자 고형물을 형성합니다. 더 크고 비극성 분자로 구성된 물질은 더 큰 매력적인 힘을 가지고 있으며 더 높은 온도에서 녹습니다.
• 영구 이폴 순간을 가진 극성 분자로 구성된 분자 고형체는 여전히 더 높은 온도에서 녹습니다. 예를 들어 솔리드 SO2 및 테이블 슈가가 있습니다. 분자 간 수소 결합은 주로 냉동 물 이나 얼음에서 볼 수 있듯이 이러한 분자 고체의 3 차원 격자를 유지 에 대 한 책임.
분자 고형물의 특성은 구성 단위인 분자의 효율적인 포장에 따라 3차원으로 달라집니다. 분자 간 힘이 접촉에 의존하기 때문에 구성 분자의 대칭이 높아서 분자 간 매력이 높은 결정 구조 내에서 닫고 컴팩트한 포장을 보장합니다. 이렇게 하면 융점이 증가합니다. 분자의 낮은 대칭은 그들의 효율적인 포장을 방지합니다. 따라서 분자 간 힘은 효과적이지 않으며 융점이 낮습니다.
이온 솔리드
염화 나트륨과 같은 이온 결정 고형은 강한 정전기 적 매력에 의해 함께 개최되는 양성 및 음이온으로 구성됩니다.
이온 고형물은 강한 이온 어트랙션으로 인해 높은 융점이 있습니다. 이온 고체의 양이온과 음이온 사이의 이온 상호 작용의 강도는 쿨롬의 법칙에 의해 주어진 정전기 력에 의해 근사 될 수있다 :
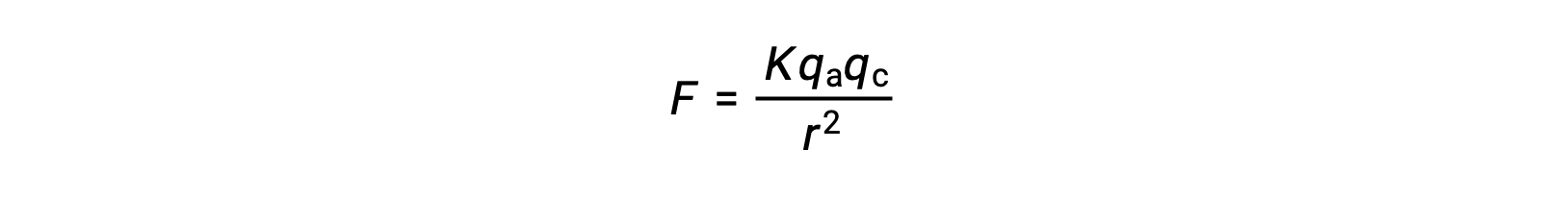
여기서, K는 비례성의 상수이며, r은 전하 사이의 거리이며, qa 및 qc는 각각 음이온과 양이온에 대한 전하를 나타낸다. 양이온과 음이온에 대한 전하가 높을수록 이온 어트랙션의 힘이 강해집니다. 마찬가지로, 결정 격자에 음이온과 양이온의 가까운 포장은 이온 어트랙션의 강한 힘을 초래, 전하 사이의 거리를 감소시킨다.
이온 고형은 단단하고, 또한 부서지기 쉬운 경향이 있으며, 구부러지기보다는 산산조각이 나립니다. 그들의 취성은 크리스탈 격자에서 매력적인 (양이온 음이온) 및 반발 (양이온 양해 및 음이온) 상호 작용의 존재에 기인한다. 강한 쿨롬빅 힘으로 인해 이온이 자유롭게 움직일 수 없기 때문에 이온 고체는 전기를 전도하지 않습니다. 그러나 용융 상태 또는 물에 용해될 때 이온은 자유롭게 이동하여 전기를 수행하게 됩니다.
표 1. 분자 및 이온 고체의 특성.
| 결정성 고체의 종류 | 구성 입자의 종류 | 어트랙션의 종류 | 속성 | 예제 |
| 분자 고형체 | 분자 | 분자 간 힘 (IMFs): 분산 력, 이폴 – 이폴 힘, 수소 결합 | 가변 경도, 가변 취성, 낮은 융점, 열및 전기의 불량 도체 | Ar, H2O (얼음), CO2 (드라이 아이스), I2,C12H22O11 (자당)
|
| 이온 솔리드 | 이온 | 정전기 | 하드, 취성, 매우 높은 융점, 용융 및 용해 상태에서 전기의 도체 | NaCl (테이블 소금), MgO (산화 마그네슘), 알2O3 (알루미나) |
이 텍스트의 일부는 Openstax, 화학 2e, 섹션 10.5: 솔리드 스테이트 오브 물질에서 채택되었습니다.
