11.15:
Solidi molecolari e ionici
11.15:
Solidi molecolari e ionici
I solidi cristallini sono divisi in quattro tipi: rete molecolare, ionica, metallica e covalente basata sul tipo di unità costituenti e sulle loro interazioni interparticellari.
Solidi molecolari
I solidi cristallini molecolari, come ghiaccio, saccarosio (zucchero da tavola) e iodio, sono solidi composti da molecole neutre come unità costituenti. Queste molecole sono tenute insieme da deboli forze intermolecolari come le forze di dispersione di Londra, le interazioni di dipolo-dipolo o i legami idrogeno, che ne dettano le proprietà (Tabella 1).
I punti di forza delle forze attrattive tra le unità presenti in cristalli diversi variano ampiamente, il che si riflette nei punti di fusione di tali cristalli.
• Piccole molecole simmetriche non polari, come H2,N2,O2e F2,hanno deboli forze di dispersione e formano solidi molecolari con punti di fusione molto bassi (inferiori a −200 °C). Le sostanze costituite da molecole non polari più grandi hanno forze attraenti più grandi e si sciolgono a temperature più elevate.
• I solidi molecolari composti da molecole polari con momenti di dipolo permanenti si sciolgono a temperature ancora più elevate. Esempi includono SO2 solido e zucchero da tavola. Il legame intermolecolare dell’idrogeno è principalmente responsabile del mantenimento del reticolo tridimensionale di tali solidi molecolari, come si vede nell’acqua congelata o nel ghiaccio.
Le proprietà dei solidi molecolari dipendono dall’imballaggio efficiente delle loro unità costituenti, le molecole, in tre dimensioni. Poiché le forze intermolecolari sono dipendenti dal contatto, una maggiore simmetria delle molecole costituenti garantisce un imballaggio stretto e compatto all’interno della struttura cristallina con elevate attrazioni intermolecolari. Ciò aumenta il punto di fusione. La minore simmetria delle molecole impedisce il loro imballaggio efficiente. Le forze intermolecolari, quindi, non sono così efficaci e il punto di fusione è inferiore.
Solidi ionici
I solidi cristallini ionici, come il cloruro di sodio, sono composti da ioni positivi e negativi che sono tenuti insieme da forti attrazioni elettrostatiche.
I solidi ionici hanno alti punti di fusione a causa delle forti attrazioni ioniche. La forza dell’interazione ionica tra i formazioni e gli anioni in un solido ionico può essere approssimata dalla forza elettrostatica, data dalla legge di Coulomb:
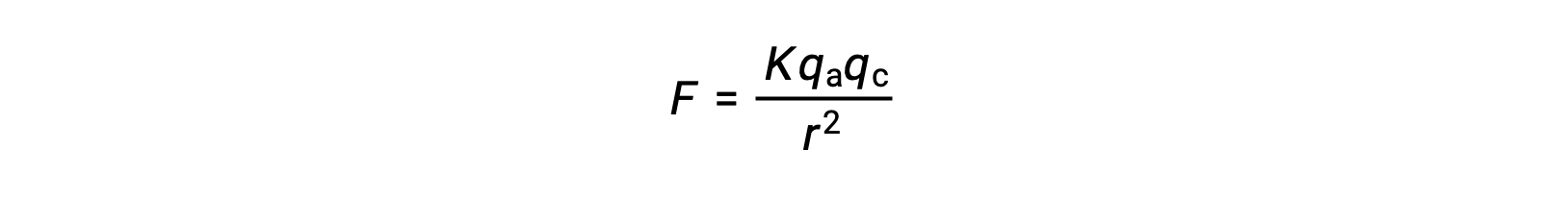
Qui, K è una costante di proporzionalità, r è la distanza tra le cariche, e qa e qcrappresentano rispettivamente le cariche sugli anioni e sui formazioni. Più alta è la carica sui ations e sugli anioni, più forte è la forza dell’attrazione ionica. Allo stesso modo, l’impacchettamento ravvicinato di anioni e formazioni nel reticolo cristallino riduce la distanza tra le cariche, risultando in forze più forti di attrazione ionica.
I solidi ionici sono duri, tendono anche ad essere fragili e si frantumano piuttosto che piegarsi. La loro fragilità è attribuita alla presenza di interazioni sia attraenti (cation-anione) che repulsive (catione-catione e anione-anione) nel reticolo cristallino. Poiché gli ioni non sono in grado di muoversi liberamente a causa delle forti forze coulombiche, i solidi ionici non conducono elettricità. Tuttavia, allo stato fuso o quando sciolti in acqua, gli ioni diventano liberi di muoversi e condurre elettricità.
La tabella 1. Caratteristiche dei solidi molecolari e ionici.
| Tipo di solido cristallino | Tipo di particella costituente | Tipo di attrazioni | Proprietà | Esempi |
| Solidi molecolari | Molecole | Forze intermolecolari (IMF): forze di dispersione, forze di dipolo-dipolo, legami idrogeno | durezza variabile, fragilità variabile, bassi punti di fusione, un conduttore povero di calore ed elettricità | Ar, H2O (ghiaccio), CO2 (ghiaccio secco), I2, C12H22O11 (saccarosio)
|
| Solidi ionici | Ioni | Elettrostatica | punti di fusione duri, fragili, da alti a molto alti, conduttore di elettricità allo stato fuso e disciolto | NaCl (sale da tavola), MgO (Ossido di magnesio), Al2O3 (allumina) |
Parte di questo testo è stato adattato da Openstax, Chimica 2e, Sezione 10.5: Lo stato solido della materia.
