11.15:
المواد الصلبة الجزيئية والأيونية
11.15:
المواد الصلبة الجزيئية والأيونية
تنقسم المواد الصلبة البلورية إلى أربعة أنواع: الجزيئية، والأيونية، والمعدنية، والشبكات التساهمية بناءً على نوع الوحدات المكونة وتفاعلاتها بين الجسيمات.
الجوامد الجزيئية
المواد الصلبة البلورية الجزيئية ، مثل الثلج والسكروز (سكر المائدة) واليود ، عبارة عن مواد صلبة تتكون من جزيئات متعادلة كوحدات مكونة لها. ترتبط هذه الجزيئات ببعضها البعض بواسطة قوى ضعيفة بين الجزيئات مثل قوى تشتت لندن ، أو تفاعلات ثنائي القطب ، أو روابط هيدروجينية ، والتي تملي خصائصها (الجدول 1).
تتنوع قوى قوى الجذب بين الوحدات الموجودة في البلورات المختلفة بشكل كبير ، وهو ما ينعكس في نقاط انصهار هذه البلورات.
• الجزيئات الصغيرة غير القطبية المتماثلة مثل H2, N2, O2, و F2 ضعيفة قوى التشتت وتشكل مواد صلبة جزيئية بنقاط انصهار منخفضة للغاية (أقل من −200 °C). المواد التي تتكون من جزيئات أكبر غير قطبية لها قوى جذب أكبر وتذوب في درجات حرارة أعلى.
• المواد الصلبة الجزيئية المكونة من جزيئات قطبية مع لحظات ثنائية القطب دائمة تذوب في درجات حرارة أعلى. تتضمن الأمثلة صلب SO2 وسكر المائدة. تعتبر الرابطة الهيدروجينية بين الجزيئات مسؤولة بشكل أساسي عن الحفاظ على الشبكة ثلاثية الأبعاد لهذه المواد الصلبة الجزيئية ، كما يظهر في الماء المجمد أو الجليد.
تعتمد خصائص المواد الصلبة الجزيئية على التعبئة الفعالة لوحداتها المكونة ، الجزيئات ، في ثلاثة أبعاد. نظرًا لأن القوى بين الجزيئات تعتمد على التلامس ، فإن التماثل العالي للجزيئات المكونة يضمن تغليفًا وثيقًا ومضغوطًا داخل الهيكل البلوري مع عوامل جذب عالية بين الجزيئات. هذا يزيد من نقطة الانصهار. يمنع التناظر السفلي للجزيئات من التعبئة الفعالة. وبالتالي ، فإن القوى بين الجزيئات ليست فعالة ، ونقطة الانصهار أقل.
المواد الصلبة الأيونية
تتكون المواد الصلبة البلورية الأيونية، مثل كلوريد الصوديوم، من أيونات موجبة وسالبة يتم تجميعها معًا بواسطة عوامل جذب إلكتروستاتيكية قوية.
المواد الصلبة الأيونية لها نقاط انصهار عالية بسبب عوامل الجذب الأيونية القوية. يمكن تقريب قوة التفاعل الأيوني بين الكاتيونات والأنيونات في مادة صلبة أيونية من خلال القوة الكهروستاتيكية المعطاة بموجب قانون كولومب’s law:
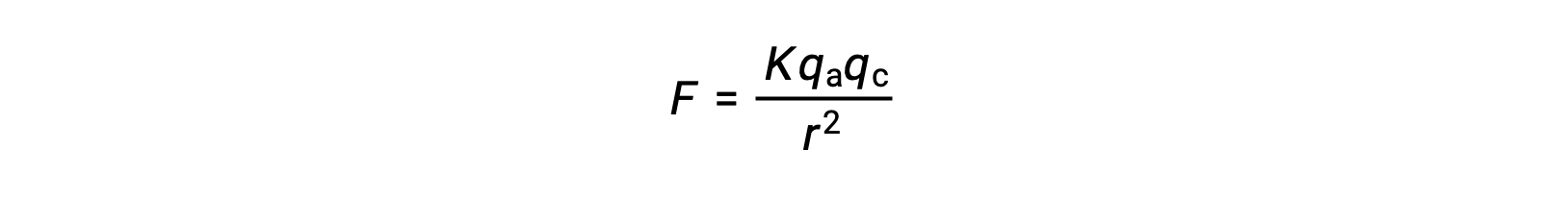
هنا، K ثابت التناسب ، r هي المسافة بين الشحنات، و q a و qc تمثل الشحنات على الأنيونات والكاتيونات، على التوالي. كلما زادت شحنة الكاتيونات والأنيونات، زادت قوة الجذب الأيوني. وبالمثل، فإن التعبئة الوثيقة للأنيونات والكاتيونات في الشبكة البلورية تقلل المسافة بين الشحنات ، مما ينتج عنه قوى جذب أيونية أقوى.
المواد الصلبة الأيونية صلبة، كما أنها تميل إلى أن تكون هشة ، وتتحطم ولا تنثني. يُعزى هشاشتها إلى وجود تفاعلات جذابة (كاتيون-أنيون) وتنافرية (كاتيون–كاتيون، وأنيون–أنيون) في الشبكة البلورية. نظرًا لأن الأيونات غير قادرة على الحركة بحرية بسبب قوى الكولومبية القوية ، فإن المواد الصلبة الأيونية لا توصل الكهرباء. ومع ذلك ، في الحالة المنصهرة أو عند إذابتها في الماء، تصبح الأيونات حرة في الحركة وتوصيل الكهرباء.
الجدول 1. خصائص المواد الصلبة الجزيئية والأيونية.
| نوع المادة الصلبة البلورية | نوع الجسيمات المكونة | نوع التجاذبات | الخصائص | أمثلة |
| المواد الصلبة الجزيئية | الجزيئات | القوى بين الجزيئات (IMF): قوى التشتت، القوى ثنائية القطب، الروابط الهيدروجينية | قساوة متغيرة، وشدة متغيرة، ونقاط انصهار منخفضة، وموصلاً رديئاً للحرارة والكهرباء | AR، H2O (ثلج)، CO2 (ثلج جاف)، I2، C12H22O11 (السكروز) |
| أيونية Solids | أيونات | إلكتروستاتي | صلبة، هشة، عالية إلى عالية نقاط الانصهار، موصل الكهرباء في حالة مولية ومذابة | NaCl (ملح الطعام)، MgO (أكسيد الماغنسيوم)، Al2O3 (ألومينا) |
تم اقتباس هذا النص من Openstax, Chemistry 2e, Section 10.5: The Solid State of Matter.
