11.15:
分子和离子晶体
11.15:
分子和离子晶体
结晶固体分为四种类型:分子,离子,金属和原子晶体 (基于组成单位类型及其粒子间交互)。
分子晶体
冰,糖 (表糖) 和碘等分子结晶固体是由中性分子组成的固体。 这些分子由弱分子间作用力 (如伦敦色散力) ,偶极 – 偶极相互作用或氢键 (决定其性质) 组成 (表 1)。
不同晶体中存在的单位之间的吸引力强度差异很大,这反映在这些晶体的熔点中。
• 小的对称非极性分子,如 H2 , N2 , O2 和 F2 , 具有弱色散力和成形分子晶体,且熔点非常低 (低于 −200 °C)。 由较大的非极性分子组成的物质具有较大的吸引力,并在较高的温度下熔化。
• 由极性分子组成的分子晶体,具有永久偶极时刻,在更高的温度下熔化。 例如固体 SO2 和糖桌。 分子间氢键主要负责维护这种分子晶体的三维晶格,如冻水或冰中所示。
分子晶体的性质依赖于三个维度内对其成分单位 (分子) 的有效堆积。 由于分子间作用力与接触相关,成分分子的更高对称性可确保在晶体结构中使用高分子间吸引力进行紧密,紧凑的填料。 这将增加熔点。 分子的对称性越低,它们的堆积效率就越低。 因此,分子间作用力没有那么有效,而熔点更低。
离子晶体
离子结晶固体 (如氯化钠) 由正负离子组成,这些离子由强静电吸引力固定在一起。
由于声波吸引力较强,离子晶体具有较高的熔点。 离子晶体中阳离子和阴离子之间的离子相互作用强度可由静电力估算,由库仑定律提供:
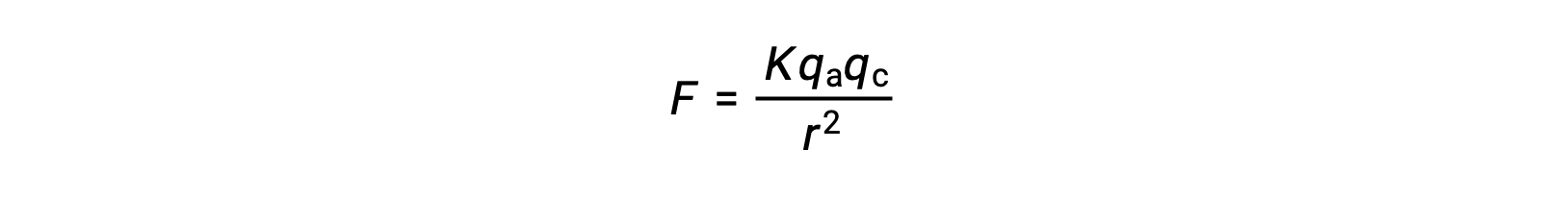
在这里, K 是一个比例常数, r 是电荷之间的距离,而 QA 和 QC 分别代表阴离子和阳离子的电荷。 阳离子和阴离子的电荷越高,离子吸引力的力越强。 同样,晶格中的阴离子和阳离子的紧密堆积会缩短电荷之间的距离,从而使离子吸引力的力更强。
离子晶体是坚硬的,它们也往往是脆性的,它们是碎落而不是弯曲的。 其脆性归因于晶格中存在吸引 (阳离子) 和排斥 (阳离子和阴离子) 相互作用。 由于强库仑力,离子无法自由移动,离子晶体不能导电。 但是,在熔融状态下或溶解在水中时,离子可以自由移动,导电也可以。
表 1. 分子和离子晶体的特征。
| 结晶固体类型 | 组成粒子的类型 | 吸引力类型 | 性质 | 示例 |
| 分子晶体 | 分子 | 分子间作用力(IMFs) :色散力,偶极 – 偶极力,氢键 | 可变硬度,可变脆性,低熔点,不良的热和电的导体 | AR , H2O (ICE) , CO2 (干冰) , I2 , C12H22O11 (sucrose)
|
| 离子晶体 | 离子 | 静电 | 坚硬的,脆性,高到极高的熔点,在熔融和溶解状态下为导电体 | NaCl (食盐) , MgO (氧化镁) , 铝 2O3 (氧化铝) |
