11.15:
Moleküler ve İyonik Katılar
11.15:
Moleküler ve İyonik Katılar
Kristalin katılar dört türe ayrılır: kurucu birimlerin türüne ve bunların parçacıklar arası etkileşimlerine bağlı olarak moleküler, iyonik, metalik ve kovalent ağ.
Moleküler Katılar
Buz, sükroz (sofra şekeri) ve iyot gibi moleküler kristal katılar, kurucu birimleri olarak nötr moleküllerden oluşan katılardır. Bu moleküller, özelliklerini belirleyen London dispersiyon kuvvetleri, dipol-dipol etkileşimleri veya hidrojen bağları gibi zayıf moleküller arası kuvvetler tarafından bir arada tutulur (Tablo 1).
Farklı kristallerde bulunan birimler arasındaki çekici kuvvetlerin gücü, bu tür kristallerin erime noktalarına yansıyan büyük ölçüde değişir.
• H2, N2, O2 ve F2 gibi küçük simetrik polar olmayan moleküller, zayıf dağılım kuvvetlerine sahiptir ve çok düşük erime noktalarına (−200 °C’nin altında) sahip moleküler katılar oluşturur. Daha büyük, polar olmayan moleküllerden oluşan maddeler daha büyük çekici kuvvetlere sahiptir ve daha yüksek sıcaklıklarda erir.
• Kalıcı dipol momentlerine sahip polar moleküllerden oluşan moleküler katılar, daha yüksek sıcaklıklarda erir. Örnekler katı SO2 ve sofra şekerini içerir. Moleküller arası hidrojen bağı, donmuş su veya buzda görüldüğü gibi, bu tür moleküler katıların üç boyutlu kafesini korumaktan sorumludur.
Moleküler katıların özellikleri, bileşen birimlerinin, yani moleküllerin üç boyutlu olarak verimli bir şekilde paketlenmesine bağlıdır. Moleküller arası kuvvetler temasa bağlı olduğundan, bileşen moleküllerin daha yüksek simetrisi, yüksek moleküller arası çekimlere sahip kristal yapı içinde yakın ve kompakt paketleme sağlar. Bu erime noktasını artırır. Moleküllerin düşük simetrisi, verimli bir şekilde paketlenmelerini önler. Moleküller arası kuvvetler bu nedenle o kadar etkili değildir ve erime noktası daha düşüktür.
İyonik Katılar
Sodyum klorür gibi iyonik kristal katılar, güçlü elektrostatik çekimlerle bir arada tutulan pozitif ve negatif iyonlardan oluşur.
İyonik katılar, güçlü iyonik çekimler nedeniyle yüksek erime noktalarına sahiptir. Bir iyonik katıdaki katyonlar ve anyonlar arasındaki iyonik etkileşimin gücü, Coulomb yasası tarafından verilen elektrostatik kuvvetle yaklaşık olarak hesaplanabilir:
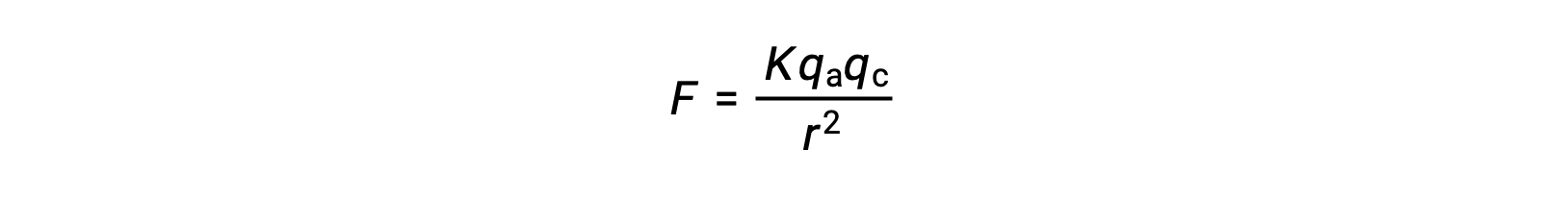
Burada, K bir orantılılık sabiti, r, yükler arasındaki mesafedir ve qa ve qc, sırasıyla anyonlar ve katyonlar üzerindeki yükleri temsil eder. Katyonlar ve anyonlar üzerindeki yük ne kadar yüksekse, iyonik çekim gücü o kadar güçlüdür. Benzer şekilde, kristal kafeste anyonların ve katyonların yakın bir şekilde paketlenmesi, yükler arasındaki mesafeyi azaltarak daha güçlü iyonik çekim kuvvetlerine neden olur.
İyonik katılar zordur, aynı zamanda kırılgan olma eğilimindedirler ve bükülmek yerine parçalanırlar. Kırılganlıkları, kristal kafeste hem çekici (katyon–anyon) hem de itici (katyon–katyon ve anyon–anyon) etkileşimlerin varlığına atfedilir. Kuvvetli kulombik kuvvetler nedeniyle iyonlar serbestçe hareket edemediğinden, iyonik katılar elektrik iletmez. Bununla birlikte, erimiş halde veya suda çözündüğünde iyonlar hareket etmekte ve elektrik iletmekte serbest hale gelir.
Tablo 1. Moleküler ve İyonik Katıların Karakteristikleri.
| Kristal Katıların Tipleri | Temel Parçacık Tipleri | Etkileşim Tipleri | Özellikler | Örnekler |
| Moleküler Katılar | Moleküller | Moleküller arası kuvvetler (IMF’ler): Dispersiyon kuvvetleri, dipol-dipol kuvvetleri, hidrojen bağları | Değişken sertlik, değişken kırılganlık, düşük erime noktaları, zayıf bir ısı ve elektrik iletkeni | Ar, H2O (buz), CO2 (kuru buz), I2, C12H22O11 (sükroz) |
| İyonik Katılar | İyonlar | Elektrostatik | sert, kırılgan, yüksek ila çok yüksek erime noktaları, erimiş ve çözünmüş durumda elektrik iletkeni | NaCl (sofra tuzu), MgO(Magnezyum Oksit), Al2O3 (Alüminyum) |
Bu yazının bu bölümü aşağıdaki kaynaktan uyarlanmıştır Openstax, Chemistry 2e, Section 10.5: The Solid State of Matter.
