12.13:
Colloïdes
12.13:
Colloïdes
Les enfants qui jouent font souvent des suspensions telles que des mélanges de boue et d’eau, de farine et d’eau, ou une suspension de pigments solides dans l’eau appelée la peinture à la tempera. Ces suspensions sont des mélanges hétérogènes composés de particules relativement grandes qui sont visibles à l’œil nu ou qui peuvent être vues avec une loupe. Elles sont troubles et les particules en suspension se déposent après qu’elles se soient mélangées. D’autre part, une solution est un mélange homogène dans lequel il n’y a pas de dépôt et dans lequel les espèces dissoutes sont des molécules ou des ions. Les solutions présentent un comportement complètement différent des suspensions. Une solution peut être colorée, mais elle est transparente, les molécules ou les ions sont invisibles et ne se déposent pas lorsqu’elle est stagnante. Une autre classe de mélanges appelés colloïdes (ou dispersions colloïdales) présente des propriétés intermédiaires entre celles des suspensions et des solutions. Les particules d’un colloïde sont plus grandes que la plupart des molécules simples ; cependant, les particules colloïdales sont suffisamment petites pour ne pas se déposer lors de la stagnation.
Préparation des systèmes colloïdaux
Les colloïdes sont préparés en produisant des particules de dimensions colloïdales et en les répartissant dans un milieu de dispersion. Les particules de taille colloïdale sont formées selon deux méthodes :
• Les méthodes de dispersion : décomposition des particules de plus grande taille. Par exemple, les pigments de peinture sont produits en dispersant les grosses particules en les broyant dans des mortiers spéciaux.
•& Les méthodes de condensation : croissance à partir de plus petites unités, comme des molécules ou des ions. Par exemple, les nuages se forment lorsque les molécules d’eau se condensent et forment de très petites gouttelettes.
Quelques substances solides, lorsqu’elles sont mises au contact de l’eau, se dispersent spontanément et forment des systèmes colloïdaux. La gélatine, la colle, l’amidon et la poudre de lait déshydraté se comportent de cette manière. Les particules sont déjà de taille colloïdale ; l’eau les disperse simplement. Les particules de lait en poudre de taille colloïdale sont produites en déshydratant du lait en spray. Certains atomiseurs produisent des dispersions colloïdales d’un liquide dans l’air.
Une émulsion peut être préparée en agitant ensemble ou en mélangeant deux liquides immiscibles. Cela divise un liquide en gouttelettes de taille colloïdale, qui se dispersent ensuite dans l’autre liquide. Les déversements de pétrole dans l’océan peuvent être difficiles à nettoyer, en partie parce que l’action des vagues peut entraîner une émulsion de pétrole et d’eau. Cependant, dans de nombreuses émulsions, la phase dispersée a tendance à se coalescer, à former de grandes gouttes et à se séparer. Par conséquent, les émulsions sont généralement stabilisées par un agent émulsifiant, une substance qui inhibe la coalescence du liquide dispersé. Par exemple, un peu de savon stabilisera une émulsion de kérosène dans l’eau. Le lait est une émulsion de matière grasse dans l’eau, avec la protéine caséine servant d’agent émulsifiant. La mayonnaise est une émulsion d’huile dans le vinaigre avec, comme agents émulsifiants, des constituants du jaune d’œuf.
Les méthodes de condensation forment des particules colloïdales à partir de l’agrégation de molécules ou d’ions. Si la grosseur des particules dépasse le champ de la taille colloïdale, des gouttes ou des précipités se forment, et aucun système colloïdal ne se produit. Les nuages se forment lorsque les molécules d’eau s’agrègent et forment des particules de la taille d’un colloïde. Si ces particules d’eau coalescent pour former convenablement de plus grosses gouttes d’eau liquide ou de plus gros cristaux d’eau solide, elles se déposent à partir du ciel sous forme de pluie, de grésil ou de neige. De nombreuses méthodes de condensation impliquent des réactions chimiques. Une suspension colloïdale rouge d’hydroxyde de fer(III) peut être préparée en mélangeant une solution concentrée de chlorure de fer(III) avec de l’eau chaude :

Un sol d’or colloïdal provient de la réduction d’une solution très diluée de chlorure d’or(III) par un agent réducteur tel que le formaldéhyde, le chlorure d’étain(II) ou le sulfate de fer(II) :
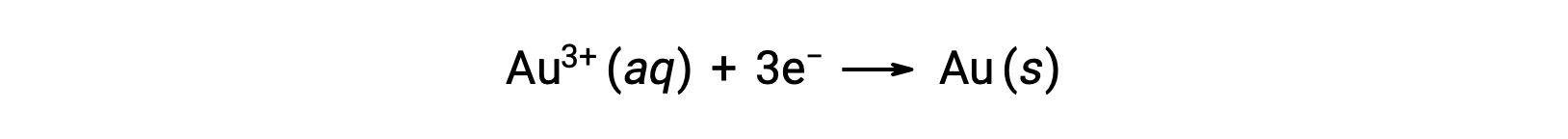
Certains sols d’or préparés en 1857 sont encore intacts (les particules n’ont pas été coalescées et stabilisés), ce qui illustre la stabilité à long terme de nombreux colloïdes.
Savons et détergents
Les pionniers ont fait du savon en faisant bouillir des graisses avec une solution fortement basique faite par lixiviation du carbonate de potassium, K2CO3, à partir de cendres de bois avec de l’eau chaude. Les graisses animales contiennent des polyesters d’acides gras (acides carboxyliques à longue chaîne). Lorsque les graisses animales sont traitées avec une base comme le carbonate de potassium ou l’hydroxyde de sodium, il se forme du glycérol et des sels d’acides gras comme l’acide palmitique, oléique et stéarique. Les sels d’acides gras sont appelés des savons. Le sel de sodium de l’acide stéarique, le stéarate de sodium, contient une chaîne hydrocarbonée non polaire non chargée, l’unité C17H35, et un groupe carboxylate ionique, l’unité COO−.
L’action de nettoyage qu’ont les savons et des détergents peut être expliquée en termes de structures des molécules impliquées. L’extrémité hydrocarbonée (non polaire) d’une molécule de savon ou de détergent se dissout dans, ou est attirée par, des substances non polaires, telles que l’huile, la graisse ou les particules de saleté. L’extrémité ionique est attirée par l’eau (polaire). En conséquence, les molécules de savon ou de détergent s’orientent à l’interface entre les particules de saleté et l’eau, de sorte qu’elles agissent comme une sorte de pont entre deux types différents de matière, non polaire et polaire. De telles molécules sont appelées amphiphiles puisqu’elles ont à la fois une partie hydrophobe (“ craignant l’eau ”) et une partie hydrophile (“ aimant l’eau ”). Par conséquent, les particules de saleté sont en suspension en tant que particules colloïdales et sont facilement lavées.
Ce texte est adapté de Openstax, Chimie 2e, Section 11.5 : Colloïdes.
Suggested Reading
- Riley, John T. "Appetizing colloids." Journal of Chemical Education 57, no. 2 (1980): 153.
- Friberg, Stig E., and Beverly Bendiksen. "A simple experiment illustrating the structure of association colloids." Journal of Chemical Education 56, no. 8 (1979): 553.
- Liang, Fuxin, Bing Liu, Zheng Cao, and Zhenzhong Yang. "Janus colloids toward interfacial engineering." Langmuir 34, no. 14 (2017): 4123-4131.
- Hansen, Robert S., and C. A. Smolders. "Colloid and surface chemistry in the mainstream of modern chemistry." (1962): 167.
