13.4:
Dereceli Reaksiyonları Tanımlama
13.4:
Dereceli Reaksiyonları Tanımlama
Hız yasaları, bir kimyasal reaksiyonun hızı ile reaktanlarının konsantrasyonu arasındaki ilişkiyi tanımlar. Bir hız yasasında, hız sabiti k ve reaksiyon sıraları, reaktanların konsantrasyonları değiştikçe reaksiyon hızının nasıl değiştiğini gözlemleyerek deneysel olarak belirlenir. Oran yasalarının belirlenmesine yönelik yaygın bir deneysel yaklaşım, başlangıç oranlarının yöntemidir. Bu yöntem, farklı başlangıç reaktan konsantrasyonları kullanılarak gerçekleştirilen çoklu deneysel denemeler için reaksiyon hızlarının ölçülmesini içerir. Bu denemeler için ölçülen hızların karşılaştırılması, birlikte bir oran yasasını formüle etmek için kullanılan reaksiyon sıralarının ve ardından hız sabitinin belirlenmesine izin verir.
Örneğin ozonla nitrik oksit içeren bir reaksiyonun hızı [NO (g) + O3 (g) ⟶ NO2 (g) + O2 (g)] laboratuvarda , başlangıç oranlarının yönteminin deneysel verilerinden belirlenebilir.
| Deneme | [NO] (mol/L) | [O3] (mol/L) | Δ[NO2]/Δt (mol/L·s) |
| 1 | 1,00 × 10−6 | 3,00 × 10−6 | 6,60 × 10−5 |
| 2 | 1,00 × 10−6 | 6,00 × 10−6 | 1,32 × 10−4 |
| 3 | 1,00 × 10−6 | 9,00 × 10−6 | 1,98 × 10−4 |
| 4 | 2,00 × 10−6 | 9,00 × 10−6 | 3,96 × 10−4 |
| 5 | 3,00 × 10−6 | 9,00 × 10−6 | 5,94 × 10−4 |
Oransal datalardan elde edilen verilere göre; Oran = k[NO]m[O3]n olarak formüle edilmiştir.. Reaksiyon derecelerinin değerleri m ve -n, ve oran sabiti k 3 aşamalı bir deneysel prosedürün takibi ile elde edilmiştir.
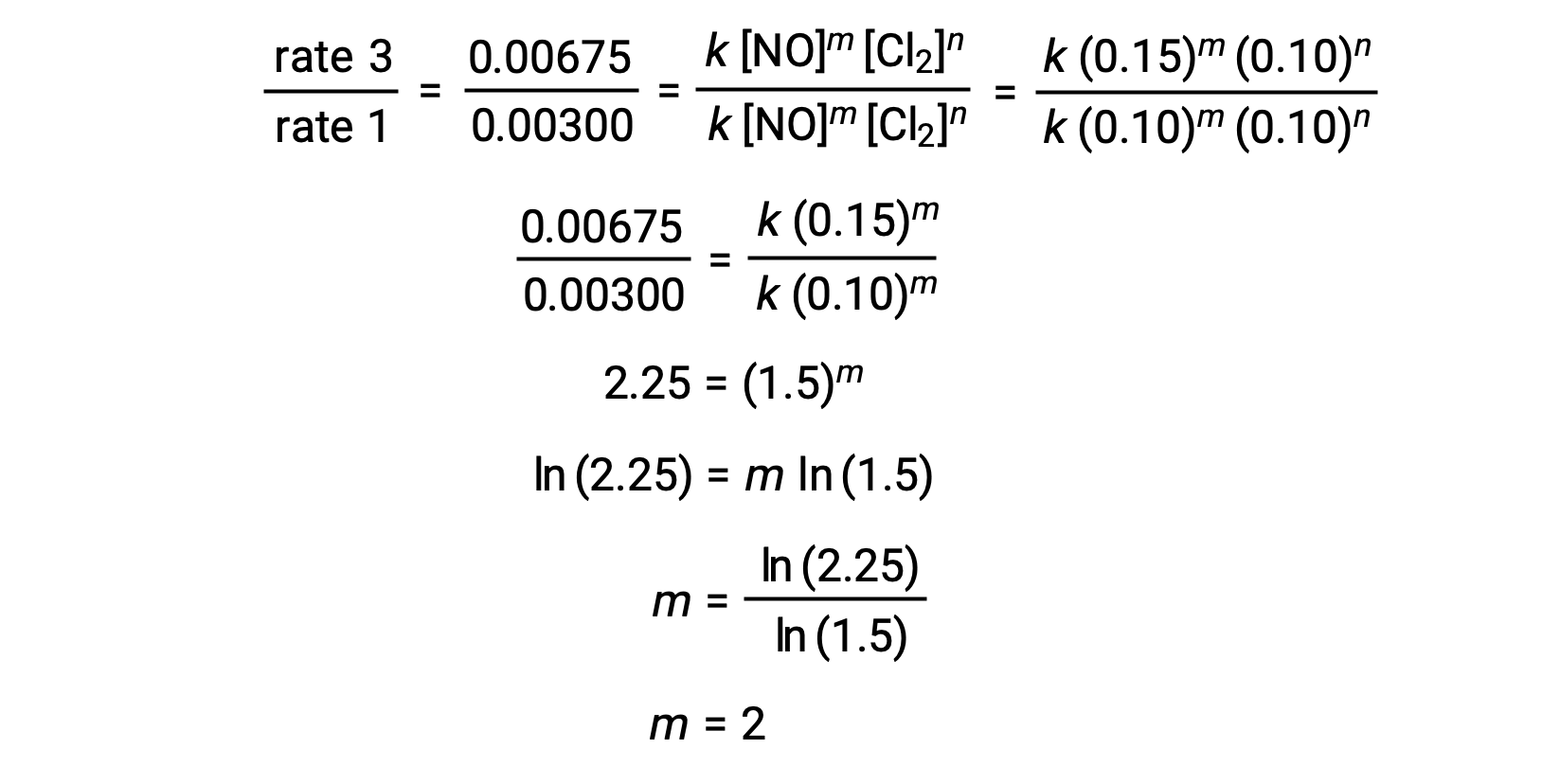
1. adımda, m‘nin değeri, [NO] ‘nun değiştiği ve [O3]’ ün sabit olduğu verilerden belirlenir. 3, 4 ve 5 numaralı denemelerde [NO], [O3] sabit kalırken değişir. [NO], deneme 3’ten 4’e iki katına çıktığında, oran iki katına çıkar ve [NO] deneme 3’ten 5’e üç katına çıktığında, oran da üç katına çıkar. Dolayısıyla, oran da [NO] ile doğru orantılıdır ve m oran yasasında 1’e eşittir.
2. adımda, n‘nin değeri [O3] ‘nun değiştiği ve [NO]’ nun sabit olduğu verilerden belirlenir. 1,2 ve 3 numaralı denemelerde [NO] sabittir ve [O3] değişir. Reaksiyon hızı, [O3] ‘daki değişiklikle doğru orantılı olarak değişir. Deneme 1’den 2’ye çıktığında oran ikiye katlanır; [O3] deneme 1’den 3’e üç katına çıktığında, oran da üç katına çıkar. Dolayısıyla, oran [O3] ile doğru orantılıdır ve n 1’e eşittir. Dolayısıyla, oran yasası: oran = k[NO]1[O3]1 = [NO][O3]
Adım 3’te, k değeri, bir konsantrasyon setinden (örneğin, deneme 1’den elde edilen veriler) ve buna karşılık gelen hızından belirlenir.
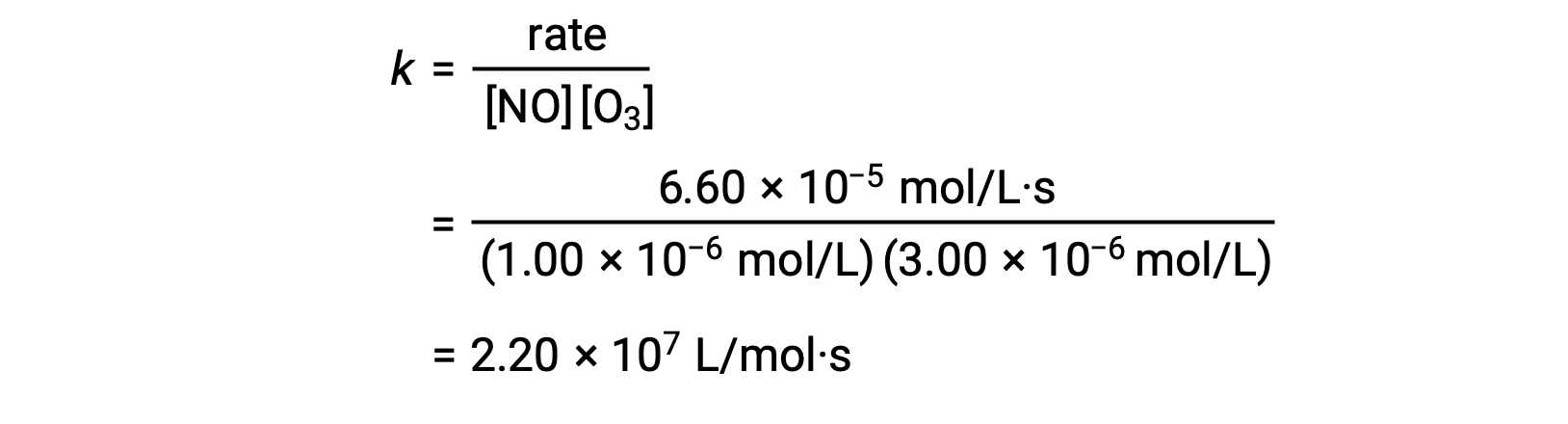
Başlangıç hızları yönteminden elde edilen verilerin doğrudan ilk konsantrasyonlar ile başlangıç hızları arasındaki ilişkiyi ima etmediği reaksiyonlarda, reaksiyon sırasını ve hız sabitini hesaplamak için hız yasalarının oranını içeren bir hesaplama kullanılabilir.
Örneğin, genel oran yasası reaksiyonu 2 NO (g) + Cl2 (g) ⟶ 2 NOCl (g) olarak ifade edilir: oran = k [NO]m [Cl2]n.
Başlangıç oranları yönteminden elde edilen veriler şunlardır:
| Denem | [NO] (mol/L) | [Cl2] (mol/L) | İlk oran (mol/L·s) |
| 1 | 0,10 | 0,10 | 0,00300 |
| 2 | 0,10 | 0,15 | 0,00450 |
| 3 | 0,15 | 0,10 | 0,00675 |
m ve n değerleri, k‘nın değerinin belirlendiği cebirsel bir yaklaşım kullanılarak deneysel verilerden belirlenebilir.
1. adımda, m‘nin değeri [NO] ‘nun değiştiği ve [Cl2]’ nin sabit olduğu verilerden belirlenir. Oran yasalarının bir oranı, iki farklı denemeden (örneğin deneme 3 ve deneme 1) alınan verilerin ikame edilmesiyle ifade edilir.
2. adımda, n‘nin değeri [Cl2] ‘nin değiştiği ve [NO]’nun sabit olduğu verilerden belirlenir.
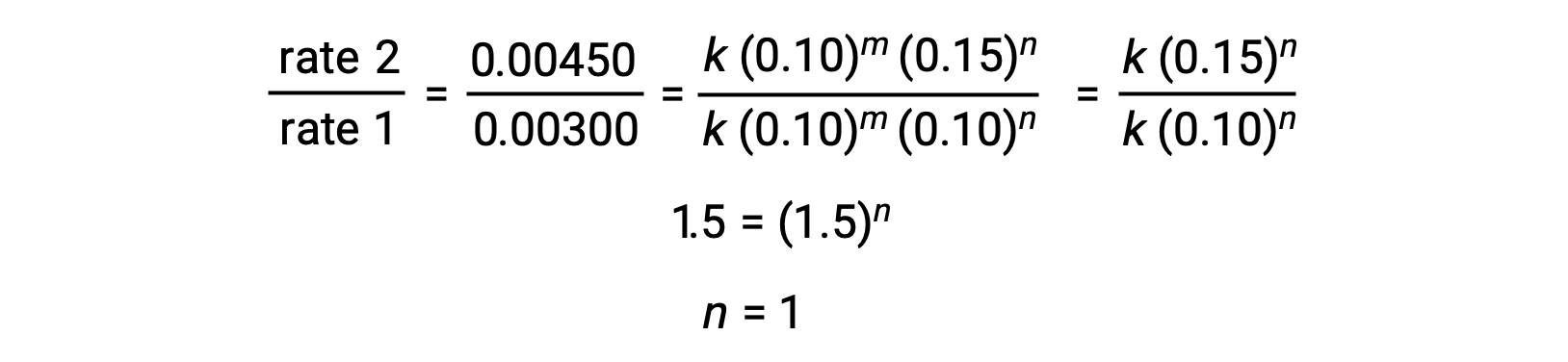
Hesaplanan m ve n değerleri kullanılarak, oran yasası oran = k[NO]2[Cl2] olarak ifade edilir.
3. adımda, hız sabiti k‘nin sayısal değeri uygun birimlerle belirlenir. Bir reaksiyon hızının birimleri mol/L·s’dir. k için birimler, oran yasasındaki diğer tüm parametrelerin birimlerini ikame ederek sonuçlandırılır. Bu örnekte, konsantrasyon birimleri mol3/L3‘tür. k için birimler, oran mol/ Ls cinsinden olacak şekilde L2/mol2·s olmalıdır. k‘nin değeri, hız yasası ifadesi çözüldükten sonra, deneysel denemelerin herhangi birindeki değerleri değiştirerek (örneğin deneme 1) belirlenir.
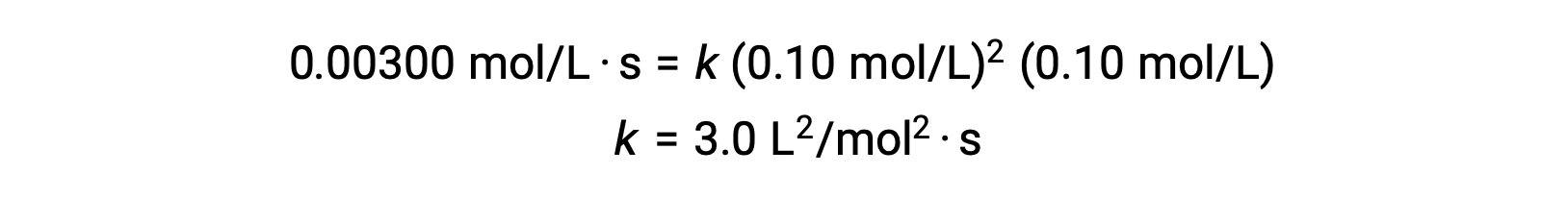
Reaksiyon Sırası ve Hız Sabit Birimleri
Bazı tepkimelerde, hız yasasındaki tepkime sıraları, tepkimenin kimyasal denklemindeki katsayılarla aynı olur. Bu sadece bir tesadüftür ve çoğu zaman durum böyle değildir. Hız yasaları, bazı reaktanlar için kesirli sıralar sergileyebilir ve bazen bir reaktantın konsantrasyonundaki bir artış reaksiyon hızında bir azalmaya neden olduğunda negatif reaksiyon sıraları gözlemlenir. Hız yasaları yalnızca deneyle belirlenir ve reaksiyon stokiyometrisi ile güvenilir bir şekilde tahmin edilmez.
The units for a rate constant will vary as appropriate to accommodate the overall order of the reaction. The unit of the rate constant for a zero-order reaction is mol/L·s (or M/s) and that for a first-order reaction is 1/s. The unit of the rate constant for a second-order reaction is L/mol·s (or 1/M·s) and that for a third-order reaction is L2/mol2·s. Although the specific units for concentration and time are indicated as (mol/L) and (s), any other valid units can be used to represent the properties of concentration and time.
Bir hız sabitinin birimleri, reaksiyonun genel sırasına uymak için uygun şekilde değişecektir. Sıfır dereceli reaksiyon için hız sabitinin birimi mol/L·s (veya M/s) ve birinci dereceden reaksiyon için 1/s’dir. İkinci dereceden bir reaksiyon için hız sabitinin birimi L/mol·s (veya 1/M·s) ve üçüncü dereceden bir reaksiyon için ise L2/mol2·s’dir. Konsantrasyon ve zaman için belirli birimler (mol/L) ve (s) olarak belirtilse de, diğer geçerli birimler konsantrasyon ve zaman özelliklerini temsil etmek için kullanılabilir.
Bu metin bu kaynaktan uyarlanmıştır Openstax, Chemistry 2e, Section 12.3: Rate Laws.
