13.4:
Determinando el Orden de Reacción
13.4:
Determinando el Orden de Reacción
Las leyes de velocidad describen la relación entre la velocidad de reacción química y la concentración de sus reactivos. En una ley de velocidad, la constante de velocidad k y los órdenes de reacción se determinan experimentalmente observando cómo cambia la velocidad de la reacción a medida que cambian las concentraciones de los reactivos. Un enfoque experimental común para la determinación de las leyes de velocidad es el método de las velocidades iniciales. Este método consiste en medir las velocidades de reacción en múltiples ensayos experimentales realizados utilizando diferentes concentraciones iniciales de reactivos. La comparación de las velocidades medidas para estos ensayos permite determinar los órdenes de reacción y, posteriormente, la constante de velocidad, que en conjunto se utilizan para formular una ley de velocidad.
La velocidad de una reacción, por ejemplo, que involucra óxido nítrico con ozono [NO (g) + O3 (g) ⟶ NO2 (g) + O2 (g)] puede determinarse a partir de los datos experimentales del método de las velocidades iniciales, en el laboratorio.
| Prueba | [NO] (mol/l) | [O3] (mol/l) | Δ[NO2]/Δt (mol/l•s) |
| 1 | 1,00 × 10−6 | 3,00 × 10−6 | 6,60 × 10−5 |
| 2 | 1,00 × 10−6 | 6,00 × 10−6 | 1,32 × 10−4 |
| 3 | 1,00 × 10−6 | 9,00 × 10−6 | 1,98 × 10−4 |
| 4 | 2,00 × 10−6 | 9,00 × 10−6 | 3,96 × 10−4 |
| 5 | 3,00 × 10−6 | 9,00 × 10−6 | 5,94 × 10−4 |
A partir de los datos de velocidad, se una ley general de velocidad; velocidad = k [NO]m [O]3n. Los valores de los órdenes de reacción m y n, y la constante de velocidad k se determinan a partir de los datos experimentales mediante un proceso de tres pasos:
En el paso 1, el valor de m se determina a partir de los datos en los que [NO] varía y [O3] es constante. En los ensayos 3, 4 y 5, [NO] varía mientras que [O3] permanece constante. Cuando [NO] se duplica de los ensayos 3 al 4, la velocidad se duplica, y cuando [NO] se triplica de los ensayos 3 al 5, la velocidad también se triplica. Por lo tanto, la velocidad también es directamente proporcional a [NO], y m en la ley de velocidad es igual a 1.
En el paso 2, el valor de n se determina a partir de datos en los que [O3] varía y [NO] es constante. En los ensayos 1,2 y 3, [NO] es constante y [O3] varía. La velocidad de reacción cambia en proporción directa al cambio en [O3]. Cuando [O3] se duplica del ensayo 1 al 2, la velocidad se duplica; cuando [O3] se triplica del ensayo 1 al 3, la velocidad aumenta también tres veces. Así, la velocidad es directamente proporcional a [O3], y n es igual a 1. Por lo tanto, la ley de velocidad es: Velocidad = k [NO]1 [O3]1 =k [NO][O3]
En el paso 3, el valor de k se determina a partir de un conjunto de concentraciones (por ejemplo, los datos del ensayo 1) y sus correspondientes velocidades.
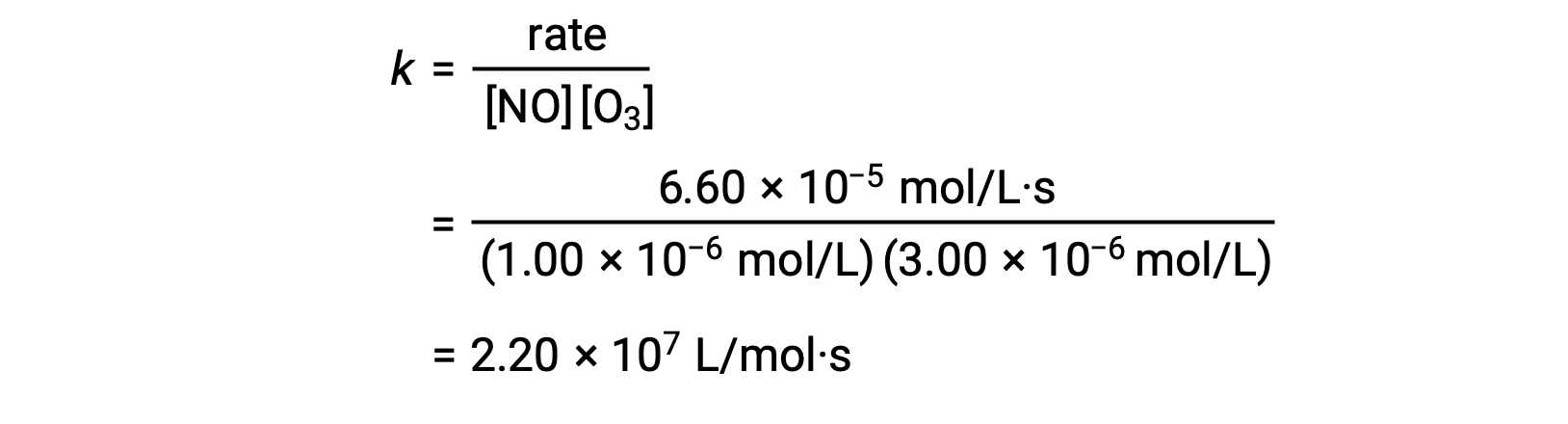
En las reacciones en las que los datos del método de las velocidades iniciales no implican directamente la relación entre las concentraciones iniciales y las velocidades iniciales, se puede emplear un cálculo que implique la relación de las leyes de velocidad para calcular el orden de reacción y la constante de velocidad.
Por ejemplo, la ley de velocidad general para la reacción 2 NO (g) + Cl2 (g) ⟶ 2 NOCl (g) se expresa como: Velocidad = k [NO]m [Cl2]n.
Los datos del método de las velocidades iniciales son:
| Prueba | [NO] (mol/l) | [Cl2] (mol/l) | Velocidad inicial (mol/l·s) |
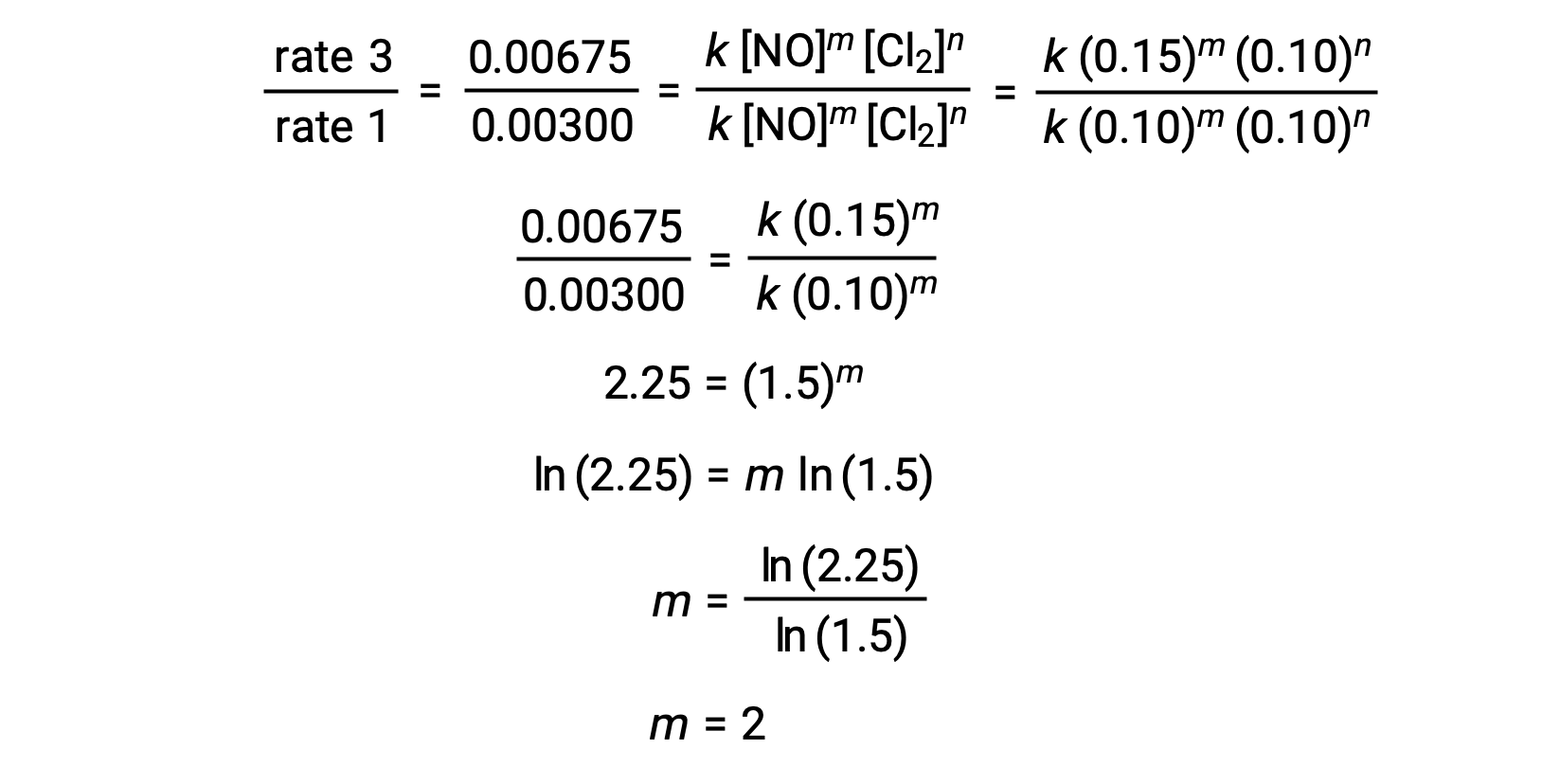
| 1 | 0,10 | 0,10 | 0,00300 |
| 2 | 0,10 | 0,15 | 0,00450 |
| 3 | 0,15 | 0,10 | 0,00675 |
Los valores de m y n pueden determinarse a partir de los datos experimentales utilizando un enfoque algebraico, tras el cual el valor de k es determinado.
En el paso 1, el valor de m se determina a partir de los datos en los que [NO] varía y [Cl2] es constante. Una proporción de leyes de velocidades se expresa sustituyendo los datos de dos ensayos diferentes (por ejemplo, el ensayo 3 y el ensayo 1).
En el paso 2, el valor de n se determina a partir de datos en los que [Cl2] varía y [NO] es constante.
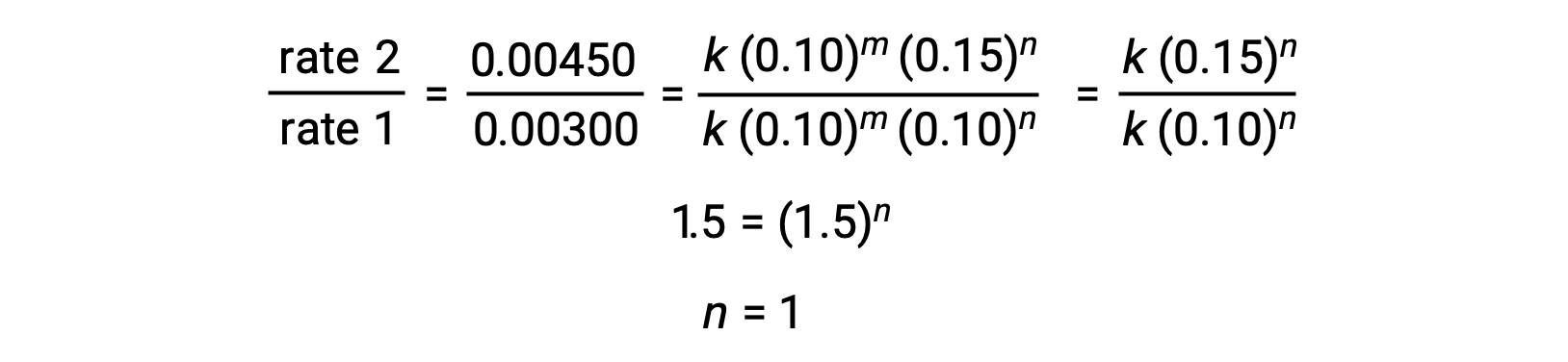
Utilizando los valores calculados de m y n, la ley de velocidad se expresa como velocidad = k [NO]2 [Cl2].
En el paso 3, el valor numérico de la constante de velocidad k es determinado con las unidades apropiadas. Las unidades para la velocidad de una reacción son mol/L·s. Las unidades de k se obtienen sustituyendo las unidades de todos los demás parámetros de la ley de velocidades. En este ejemplo, las unidades de concentración son mol3/L3/sup>. Las unidades para k deben ser de L2/mol2·s de modo que la velocidad sea en términos de mol/L·s. El valor de k se determina una vez que se ha resuelto la expresión de la ley de velocidades, simplemente sustituyendo los valores de cualquiera de los ensayos experimentales (por ejemplo, el ensayo 1).
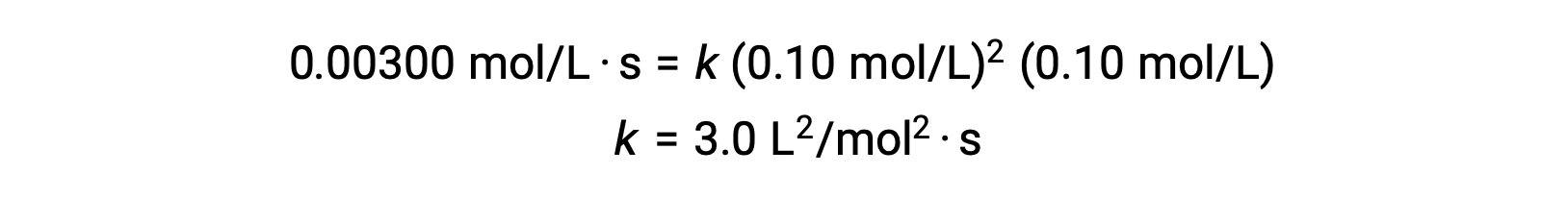
El orden de reacción y las unidades de la constante de velocidad
En algunas reacciones, los órdenes de reacción en la ley de velocidad son los mismos que los coeficientes en la ecuación química para la reacción. Esto es simplemente una coincidencia y muy a menudo no es así. Las leyes de velocidad pueden mostrar órdenes fraccionarios para algunos reactivos, y en ocasiones se observan órdenes de reacción negativos cuando un aumento en la concentración de un reactivo provoca una disminución en la velocidad de la reacción. Las leyes de velocidad son determinadas solo experimentalmente y no son predecibles de manera confiable mediante la estequiometría de la reacción.
Las unidades de una constante de velocidad variarán según corresponda para acomodar el orden general de la reacción. Las unidades de la constante de velocidad para una reacción de orden cero es mol/L·s (o M/s) y la de una reacción de primer orden es 1/s. Las unidades de la constante de velocidad para una reacción de segundo orden es L/mol·s (o 1/M·s) y las de una reacción de tercer orden son L2/mol2·s. Aunque las unidades específicas de concentración y tiempo se indican como (mol/L) y (s), cualquier otra unidad válida puede utilizarse para representar las propiedades de concentración y tiempo.
Este texto es adaptado de Openstax, Química 2e, Sección 12.3: Leyes de velocidad.
