13.4:
Détermination de l'ordre de réaction
13.4:
Détermination de l'ordre de réaction
Les lois de vitesse décrivent la relation entre la vitesse d’une réaction chimique et la concentration de ses réactifs. Dans une loi de vitesse, la constante de vitesse k et les ordres de la réaction sont déterminés expérimentalement en observant comment la vitesse de réaction change au fur et à mesure que les concentrations des réactifs sont modifiées. Une approche expérimentale courante pour la détermination des lois de vitesse est la méthode des vitesses initiales. Cette méthode consiste à mesurer les vitesses de réaction pour de multiples essais expérimentaux réalisés en utilisant différentes concentrations initiales de réactifs. La comparaison des vitesses mesurées pour ces essais permet de déterminer les ordres de la réaction et, par la suite, la constante de vitesse, qui conjointement servent à formuler une loi de vitesse.
La vitesse d’une réaction, par exemple, impliquant l’oxyde nitrique avec l’ozone [NO (g) + O3 (g) ⟶ NO2 (g) + O2 (g)] peut être déterminée à partir des données expérimentales de la méthode des vitesses initiales, en laboratoire.
| Essai | [NO] (mol/L) | [O3] (mol/L) | Δ[NO2]/Δt (mol/L·s) |
| 1 | 1,00 × 10−6 | 3,00 × 10−6 | 6,60 × 10−5 |
| 2 | 1,00 × 10−6 | 6,00 × 10−6 | 1,32 × 10−4 |
| 3 | 1,00 × 10−6 | 9,00 × 10−6 | 1,98 × 10−4 |
| 4 | 2,00 × 10−6 | 9,00 × 10−6 | 3,96 × 10−4 |
| 5 | 3,00 × 10−6 | 9,00 × 10−6 | 5,94 × 10−4 |
À partir des données de vitesse, on formule une loi de vitesse générale ; vitesse = k[NO]m[O3]n. Les valeurs des ordres de réaction m et n et de la constante de vitesse k sont déterminées à partir des données expérimentales en utilisant un procédé en trois parties :
À l’étape 1, la valeur de m est déterminée à partir des données dans lesquelles [NO] varie et [O3] est constant. Dans les essais 3, 4 et 5, [NO] varie alors que [O3] reste constant. Lorsque [NO] double de l’essai 3 à 4, la vitesse double, et quand [NO] triple de l’essai 3 à 5, la vitesse triple également. Ainsi, la vitesse est également directement proportionnelle à [NO], et m dans la loi de vitesse est égal à 1.
À l’étape 2, la valeur de n est déterminée à partir de données dans lesquelles [Cl2] varie et [NO] est constant.
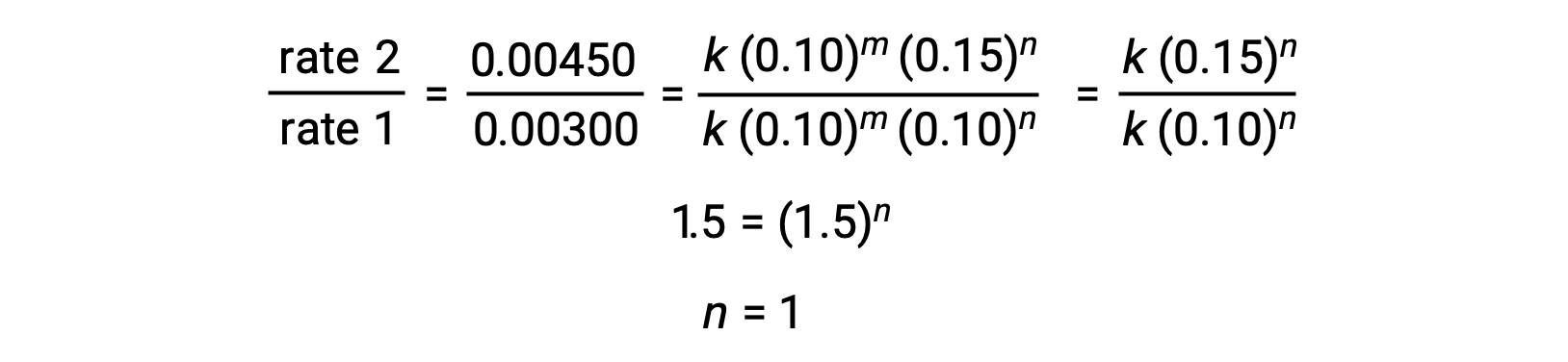
En utilisant les valeurs calculées dem et n, la loi de vitesse est exprimée sous la forme vitesse = k[NO]2[Cl2].
À l’étape 3, la valeur numérique de la constante de vitesse k est déterminée avec les unités appropriées. Les unités de la vitesse d’une réaction sont mol/L·s. Les unités de k sont déduites en substituant les unités de tous les autres paramètres de la loi de vitesse. Dans cet exemple, les unités de concentration sont mol3/L3. Les unités de k doivent être L2/mol2·s de sorte que la vitesse soit en mol/L·s. La valeur de k est déterminée une fois que l’expression de la loi de vitesse a été résolue, en substituant simplement les valeurs de n’importe lequel des essais expérimentaux (par exemple, l’essai 1).
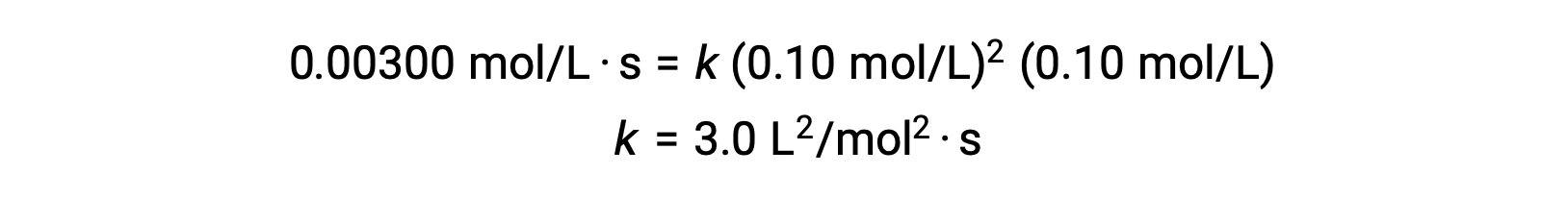
Ordre de réaction et unités de la constante de vitesse
Dans certaines réactions, il se peut que les ordres de réaction dans la loi de vitesse soient les mêmes que les coefficients dans l’équation chimique de la réaction. Ce n’est qu’une coïncidence et pas le cas très souvent. Les lois de vitesse peuvent présenter des ordres fractionnaires pour certains réactifs, et des ordres de réaction négatifs sont parfois observés lorsqu’une augmentation de la concentration d’un réactif entraîne une diminution de la vitesse de réaction. Les lois de vitesse sont déterminées expérimentalement uniquement et ne sont pas prédites de façon fiable d’après la stœchiométrie de la réaction.
Les unités d’une constante de vitesse varient selon l’ordre global de la réaction. L’unité de la constante de vitesse pour une réaction d’ordre zéro est mol/l#183;s (ou M/s) et celle d’une réaction de premier ordre est 1/s. L’unité de la constante de vitesse pour une réaction de deuxième ordre est L/mol#183;s (ou 1/M#183;s) et celle d’une réaction de troisième ordre est L2/mol2#183;s. Bien que les unités spécifiques de concentration et de temps soient indiquées par (mol/L) et (s), toute autre unité valable peut être utilisée pour représenter les propriétés de concentration et de temps.
Ce texte est adapté de Openstax, Chimie 2e, Section 12.3 : Lois de vitesse.
